满足您对COVID-19检测和生物标记物的需求
在我们科学和运营专家的帮助下,从我们全球整合的中心实验室网络中挖掘最大价值。凭借过去五年间在各个治疗领域开展超过4,400项临床试验所积累的深厚经验,我们懂得如何优化您的研究并减少潜在问题,以适应冠状病毒(COVID-19)研究的快节奏。

丰富的技术和跨职能经验,满足您的COVID-19测试需求。 As the world's leading network of clinical research central labs, Labcorp Central Laboratories deliver globally consistent, actionable data to drive your COVID-19 studies forward - faster.
在我们科学和运营专家的帮助下,从我们全球整合的中心实验室网络中挖掘最大价值。凭借过去五年间在各个治疗领域开展超过4,400项临床试验所积累的深厚经验,我们懂得如何优化您的研究并减少潜在问题,以适应冠状病毒(COVID-19)研究的快节奏。
COVID-19的几种检测方法正在快速验证中,以满足试验测试标准。
可用于排除其他呼吸系统疾病的检测套组已通过验证,符合临床试验测试标准。
Each year, we generate over 55 million reported results. (source: Labcorp CLA Internal Metrics 2018)
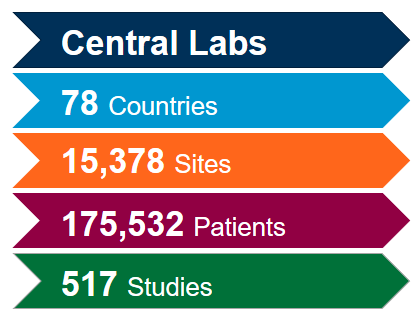
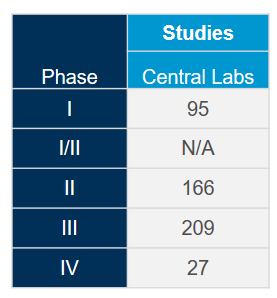
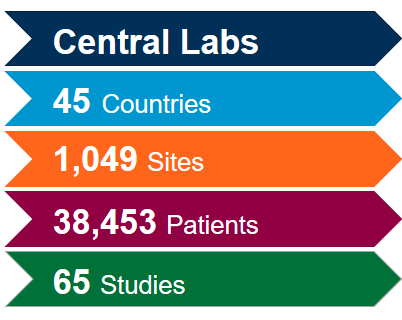
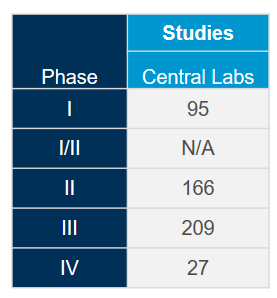
批准用于COVID-19试验的专有方法:
羟氯喹
GeneXpert®为Cepheid的商标
BioFire® FilmArray®为BioFire Diagnostics LLC的商标
联系我们的COVID-19响应团队
联系我们