作者: Sumithra Urs,博士 | 高级科研科学家
Date: December 2019
皮肤癌包括皮肤各层的癌变,其中最常见的是基底细胞癌(BCC)和鳞状细胞癌(SCC)。黑色素瘤和非黑色素瘤皮肤癌(梅克尔细胞癌、卡波西氏肉瘤、皮肤淋巴瘤和其他肉瘤)很少见。在所有类型的皮肤癌中,黑色素瘤是一种始于黑色素细胞的严重皮肤癌,黑色素细胞是皮肤表皮底层(基底层)会产生黑色素的神经嵴来源细胞。尽管恶性BCC和SCC很少转移,但另一方面,较不常见的恶性黑色素瘤具有高度侵袭性,并会迅速扩散到身体的其他部位。黑色素瘤有许多不同的形状、大小和颜色,并会出现一系列预警现象。[1]
黑色素瘤在早期发现和治疗后可以治愈,据估计,美国患者的五年生存率为98%。[2] 黑色素瘤一旦侵入皮肤或身体其他部位,就更难治疗并且可能致命。据美国癌症协会估计,到2019年,美国新增黑色素瘤病例约为192,310,其中96,480例将为侵入性,将有大约7,230人死于黑色素瘤。过去几十年中,黑色素瘤的发病率迅速上升,黑色素瘤是年轻人(尤其是年轻女性)中最常见的癌症之一。浅肤色是黑色素瘤的一大主要风险因素,尽管没有种族对此免疫,但白人的患病率是非裔美国人的20倍。每个人的患病风险可能受到多种因素的影响,包括日晒、紫外线、痣、既往癌症、遗传和家族因素。
治疗方案取决于疾病阶段、肿瘤位置和患者的整体健康状况,并包括手术切除黑素瘤、免疫治疗、靶向治疗、化疗和放疗。常用的单药疗法靶向B-RAF基因、C-KIT基因和其他异常基因中的突变。另外,也可以使用达卡巴嗪、替莫唑胺、纳布紫杉醇、顺铂和卡铂等化疗药物治疗。针对IL-2、伊匹单抗(CTLA-4抑制剂)以及派姆单抗和尼武单抗(PD-1抑制剂)的临床试验正在进行并且正在积极招募患者。这些免疫调节药物也正在联合用药以及新辅助治疗方案中进行测试。此外,黑色素瘤疫苗、III期黑色素瘤的BCG疫苗和溶瘤病毒(T-VEC)也在接受测试。[3] 新的治疗方案侧重于改善晚期黑色素瘤患者的生活质量并提高生存率。
鼠B16黑色素瘤模型是临床前研究中最常用的转移性黑色素瘤模型。 We have established the syngeneic B16-F10 model to evaluate responses to immuno-oncology agents and support development of novel therapeutics.B16-F10细胞系是作为C57BL/6小鼠中B16亲本肿瘤的10连续传代亚克隆生成的细胞系。[4] 在体外,这些细胞以黏附细胞群的形式生长,呈现上皮形态。 在体内,在C57BL/6小鼠中皮内植入B16-F10细胞会导致肿瘤侵袭性生长。我们的生长研究表明,经过一系列接种后出现有效的生长动力学,倍增时间大约为2-3天(图1)。对照动物在达到过度肿瘤负荷的安乐死标准之前20-25天继续接受研究。这就促成了一个模型,该模型可以促进长达两周的给药窗口,供受试药物激发其抗肿瘤活性。尽管该模型本身并不会造成体重减轻,但肿瘤结痂和溃疡是与皮下和皮内B16-F10肿瘤生长相关的常见临床症状。
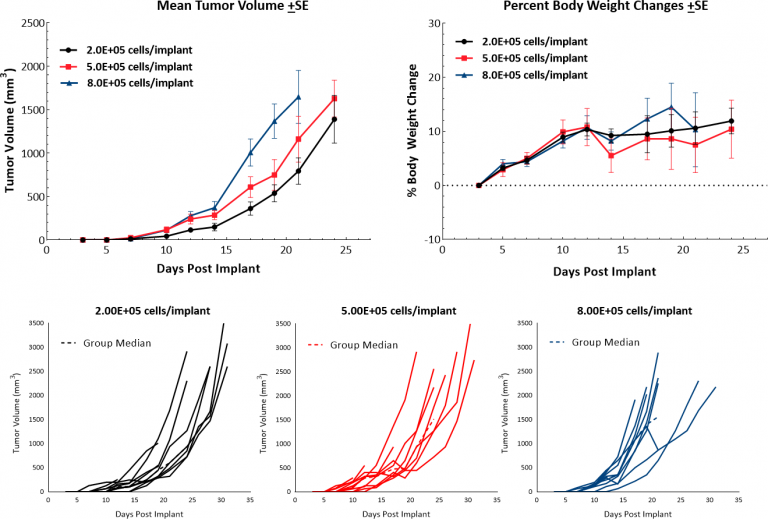
图1:在C57BL/6小鼠中皮内植入B16-F10后的生长动力学和体重变化。
B16-F10肿瘤免疫特征
Baseline immune profiling of B16-F10 tumor infiltrates was determined by flow cytometry on 5 untreated tumors (300-500mm3) and analyzed using the CompLeukocyteTM package. The immune cell infiltration in the tumor microenvironment, represented a percent of CD45+ cells, showed a distinct immune cell population dominated mostly by undefined CD11b+ myeloid cells characteristic to this tumor model (Fig 2). M2 TAM(19%)、G-MDSC(15%)和M-MDSC(11%)的比例相对较高,而M1 TAM(1.4%)和树突状细胞(4%)群的比例相对较低。淋巴样细胞群主要由B细胞(7.3%)和NK(4%)细胞组成,其中T细胞向肿瘤的浸润最少。总体免疫特征表示此为非免疫原性模型。
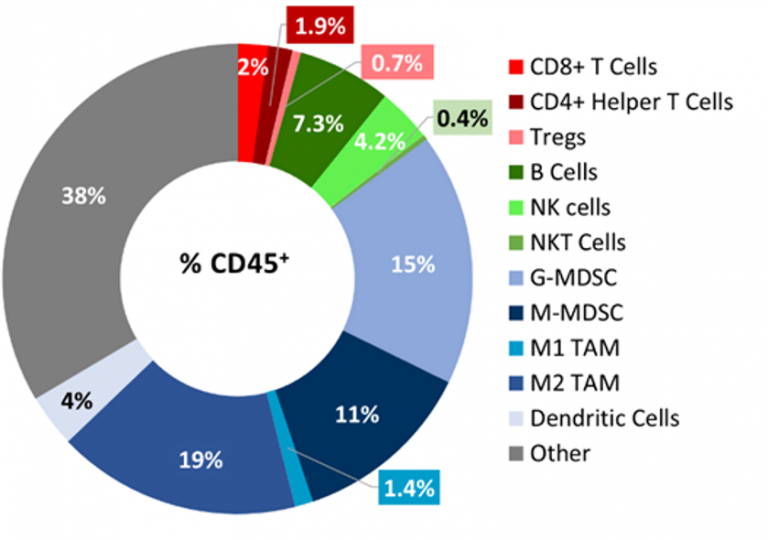
图2:浸润B16-F10模型的肿瘤免疫细胞免疫表型。
B16-F10对治疗的反应
免疫调节剂:
We have investigated a number of immune modulatory antibodies in this model. 当肿瘤达到约90mm3时开始治疗,检查点抑制剂抗mPD-1或抗mPD-L1在皮下B16-F10肿瘤中未产生任何反应(图3A)。同样,最早在植入四天后就开始使用抗mCTLA-4或抗mLAG-3的治疗也没有产生任何反应(图3A)。最后,当我们用TNF受体家族共刺激受体CD137治疗B16-F10肿瘤时,我们没有看到任何抗肿瘤活性(图3B)。鉴于幼稚型B16-F10肿瘤具有免疫抑制性肿瘤微环境,单药免疫调节剂引起有限反应/无反应也就不足为奇了,这种反应缺乏表明这是一种免疫学冷性肿瘤模型,如B16-F10所报告。
![图{[#0]}:在C57BL/6小鼠中用检查点抑制剂(A)或抗mCD137(B)治疗后,B16-F10肿瘤的反应。](https://biopharma.labcorp.com/industry-solutions/by-therapeutic-area/oncology/preclinical/tumor-spotlights/b16-f10-a-murine-melanoma-model/_jcr_content/root/responsivegrid_left/image_copy_copy.coreimg.png/1670865551008/1581530538891.png)
图{[#0]}:在C57BL/6小鼠中用检查点抑制剂(A)或抗mCD137(B)治疗后,B16-F10肿瘤的反应。
放射治疗:
放射治疗(RT)用于不适合手术或拒绝手术治疗的黑色素瘤患者。我们评估了皮下B16-F10肿瘤对Xstrahl小型动物放射研究平台(SARRP)传输的单剂量局部放射的敏感性。10、15或20 Gy剂量的放射治疗在至少50%的动物中显示出抗肿瘤活性,导致10、15和20 Gy RT分别出现5.9、14或10.5天的剂量反应性肿瘤生长延迟,分别表明B16-F10黑色素瘤模型对放射有反应(图4)。但是,即使以最高测试剂量进行治疗也不会导致明显的消退或任何无肿瘤幸存者。因此,在临床前环境中利用SARRP进行局部放射治疗可能有助于评估联合治疗以模拟包括放射治疗在内的临床研发路径。
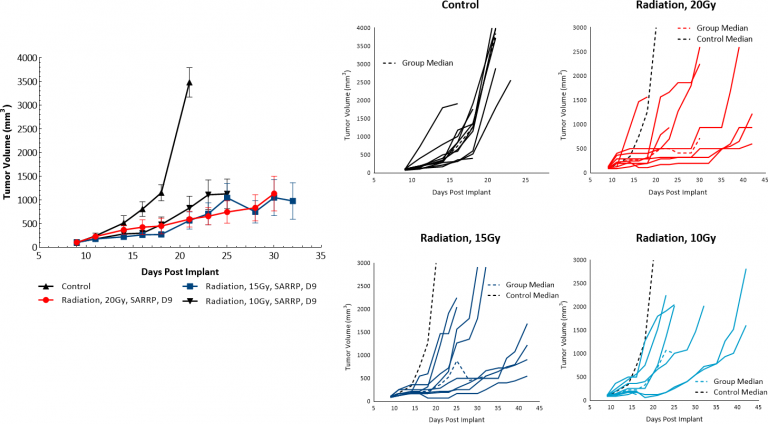
图4:C57BL/6小鼠中B16-F10肿瘤对局部放射的反应。
黑色素瘤患者采用免疫调节剂和化疗或放疗联合治疗是改善患者反应的潜在途径。[5]此外,联合治疗也可能有助于改变肿瘤的免疫冷性特征,营造出更具接受性/反应性的肿瘤微环境以使肿瘤变得更易于治疗。 To discuss how the B16-F10 model would be useful in your next immunotherapy study, contact the scientists.
参考资料
1https://www.skincancer.org/skin-cancer-information/melanoma/melanoma-warning-signs-and-images/。
2SEER癌症统计资料。美国国家癌症研究所,NIH(https://www.cancer.gov)。
3 NCI黑色素瘤临床试验(https://www.cancer.gov/about-cancer/treatment/clinical-trials/disease/melanoma)。
4 Nakamura K等人。通过使用实验性转移模型表征小鼠黑素瘤细胞系的致命恶性。《Life Sci》2002年1月4日;70(7):791-8。DOI:10.1016/s0024-3205(01)01454-0。
5 Schwartz AL等人。CD47的反义靶向可增强人类细胞毒性T细胞活性,并联合抗CTLA4和肿瘤放射以提高B16黑色素瘤荷瘤小鼠的存活率。《Cancer Immunol Immunother》。2019年10月18日。DOI:10.1007/s00262-019-02397-7。
让我们开始对话
联系我们