作者:Sheri Barnes博士,科研总监
Date: May 2018
乳腺癌是美国女性中最常见的癌症,是导致癌症死亡的第四大原因。据估计,2017年新诊断出的病例为252,710例(占所有新增癌症病例的15%),同时有40,610例患者死亡。早期发现计划以及改进的治疗方案已使5年总生存率从1975年的75%提高到今天的90%。[1] 尽管统计的生存率良好,但转移性疾病仍然是治疗难题,并常常会导致死亡。因此,有必要不断研发新的乳腺癌治疗方法。
使用免疫肿瘤学联合疗法治疗乳腺癌的进展
虽然有几种治疗方法可用于治疗激素或Her2乳腺癌,但对于不能使用这些靶向疗法治疗的三阴性乳腺癌患者,其可选的治疗方案有限。 除此以外,尽管免疫疗法在治疗黑色素瘤和肺癌方面取得了成功,但事实证明,通过检查点阻断或其他免疫疗法很难治疗乳腺癌。 However, with the focused effort in recent years towards immuno-oncology approaches to breast cancer, emerging clinical data is showing promise, particularly in combination therapy.[2] To help drive this research forward, we have developed the EMT-6 syngeneic breast tumor model. 源自BALB/c小鼠的移植性增生性肺泡结节,[3]该模型利用了完整的小鼠免疫系统,并在免疫肿瘤学领域发挥了强大的作用。
使用EMT-6模型测试联合疗法
乳腺癌是美国女性中最常见的癌症,是导致癌症死亡的第四大原因。据估计,2017年新诊断出的病例为252,710例(占所有新增癌症病例的15%),同时有40,610例患者死亡。早期发现计划以及改进的治疗方案已使5年总生存率从1975年的75%提高到今天的90%。[1] 尽管统计的生存率良好,但转移性疾病仍然是治疗难题,并常常会导致死亡。因此,有必要不断研发新的乳腺癌治疗方法。
使用免疫肿瘤学联合疗法治疗乳腺癌的进展
虽然有几种治疗方法可用于治疗激素或Her2乳腺癌,但对于不能使用这些靶向疗法治疗的三阴性乳腺癌患者,其可选的治疗方案有限。 除此以外,尽管免疫疗法在治疗黑色素瘤和肺癌方面取得了成功,但事实证明,通过检查点阻断或其他免疫疗法很难治疗乳腺癌。 However, with the focused effort in recent years towards immuno-oncology approaches to breast cancer, emerging clinical data is showing promise, particularly in combination therapy.[2] To help drive this research forward, we have developed the EMT-6 syngeneic breast tumor model. 源自BALB/c小鼠的移植性增生性肺泡结节,[3]该模型利用了完整的小鼠免疫系统,并在免疫肿瘤学领域发挥了强大的作用。
使用EMT-6模型测试联合疗法
在此模型聚焦中,我们介绍了使用EMT-6模型进行的初始功效研究得出的数据。这些数据应当能够支持设计出与新型疗法联合治疗的合理研究,同时进行其他研究。EMT-6模型的对照肿瘤生长如图1所示。倍增时间中位数平均为5.5天,从而带来至少三周的治疗时间窗以引发抗肿瘤活性。未经治疗的肿瘤和经同种型对照抗体(大鼠IgG2b)治疗的肿瘤的生长速率几乎可以叠加。为了确定EMT-6对免疫调节疗法的反应,使用检查点阻断(抗mPD-1和抗mPD-L1)以及抗mCD137(一种共刺激分子)对EMT-6荷瘤小鼠进行了治疗。此外,由于局部放射通常用于治疗乳腺癌,因此我们对放疗单一疗法和联合疗法进行了建模。
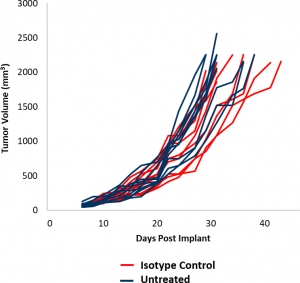
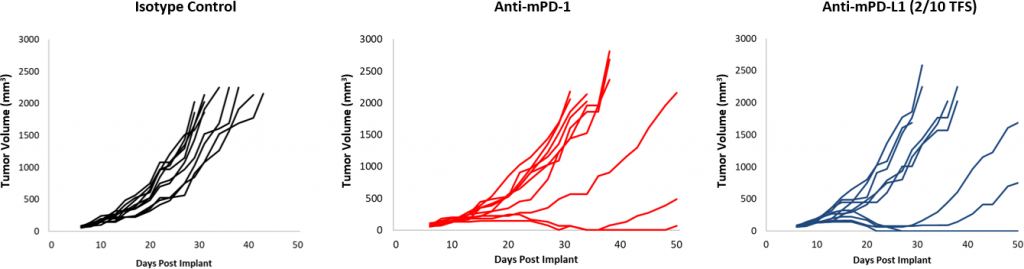
图2:EMT-6对检查点抑制剂的反应
与对照组相比,对检查点阻断的总体反应中等(图2)。尽管有一部分动物确实有反应,但抗mPD-1和抗mPD-L1治疗仍然为联合治疗提供了改进空间。此外,10Gy剂量的局部放射在其他同基因模型中引起明显的肿瘤生长延迟,但在EMT-6中仅有适度的活性。在该方案中添加抗mPD-1会带来一些附加影响,但仍然为三联疗法带来了改进空间。 相反,抗mCD137单一疗法会导致针对EMT-6的强烈反应(4/10 TFS)。联合局部放射治疗相比抗mCD137单一疗法(图3)可带来名义上的改善(5/10 TFS)。这些数据证明了使用MT-6模型研究利用放射、检查点阻断和/或共刺激分子激动剂的双联或三联策略的优势。
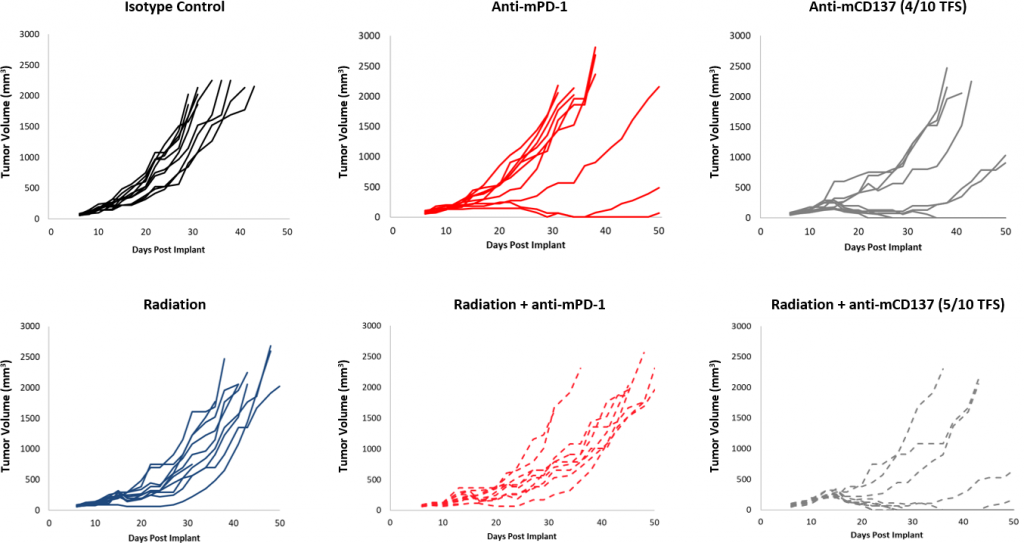
图3:EMT-6对局部放射联合治疗的反应
肿瘤内浸润性免疫细胞的成分
在研究免疫肿瘤学模型时,了解肿瘤中的浸润性免疫细胞的组成也很重要。为此,我们研究了220-385 mm3之间的肿瘤中的浸润性T细胞和骨髓细胞,并以在CD45+细胞总数中所占的百分比来表示(图4)。所有肿瘤的骨髓区室均匀分布在M2巨噬细胞、单核MDSC和粒细胞MDSC中。M1巨噬细胞浸润相对低于其他髓样来源细胞。这种组成表明了免疫抑制性微环境,这有助于解释为什么大多数接受测试的免疫疗法均仅出现有限反应。
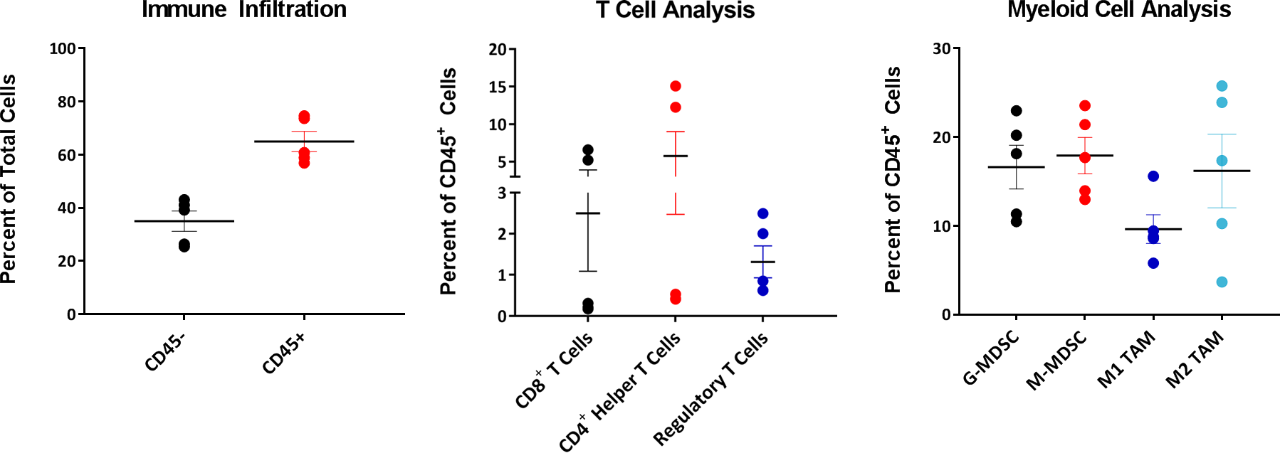
图4:EMT-6浸润性T细胞和骨髓细胞分析
相比之下,T细胞区隔显示出肿瘤间变异性,其中3/5的肿瘤表现出极低水平的CD4+和CD8+ T细胞。有趣的是,与CD4+和CD8+ T细胞浸润相比,这些肿瘤中的Treg组成在肿瘤间的变异性要小得多。目前正在开展研究以确定在这些EMT-6肿瘤中浸润性CD4+和CD8+ T细胞的变异是该模型生物学所固有的,还是在给定样本量较大的情况下,变异可以正常化。
EMT-6 - 完善的临床前免疫肿瘤学模型
EMT-6同基因乳腺癌模型具有良好的免疫特性,可以用作完善的临床前免疫肿瘤学模型。我们的数据支持使用该工具来研究与放疗、检查点抑制剂或共刺激分子联合使用的新型疗法。
MODEL SPOTLIGHT | EMT-6 Syngeneic Breast Tumor Model – A Powerful Tool for Immuno-Oncology Studies (PDF Version)
参考资料
让我们开始对话
联系我们