Date: February 2021
Successful treatment of breast cancer by immunotherapy continues to be a challenge, but emerging clinical data is encouraging.3 To help enable preclinical research of immunotherapy in breast cancer, we have developed the orthotopic EMT6 syngeneic breast tumor model in 2018.
The EMT6 model was derived from a transplanted hyperplastic alveolar metastatic lung nodule in BALB/c mice.4 As further data was generated with this model, observations of metastatic foci in the lung visible upon gross necropsy occurred in up to 40% of control mice. As metastasis is common in breast cancer patients, it was important to take advantage of this finding, so a luciferase enabled EMT6 cell line (EMT6-Luc) was generated to monitor thoracic metastasis by bioluminescence imaging (BLI) 体内. For this project, animal care and use was conducted according to animal welfare regulations in an AAALAC-accredited facility with IACUC protocol review and approval.
在本篇聚焦文章中,我们将通过对原始肿瘤的卡尺测量和胸腔区域的BLI测量,将最初植入乳腺脂肪垫(MFP)的EMT6-Luc模型的初始功效研究中的数据呈现出来,以监测转移性疾病的进展。图1显示了EMT6和EMT6-Luc模型的对照肿瘤生长。对于亲代和EMT6-Luc模型,MFP肿瘤的倍增时间中位数为5.5天,从而带来两至三周的治疗时间窗以引发受试药物的抗肿瘤活性。

图1. 将原位(乳腺脂肪垫)植入雌性Balb/c小鼠的EMT6 (A)和EMT6-Luc (B)的个体对照生长。
为确定EMT6-Luc对检查点阻断的反应,使用抗mPD-1或抗mPD-L1治疗携带EMT6-Luc肿瘤的小鼠。与对照相比,对检查点阻断的反应适中(图2),EMT6-Luc中对抗mPD-1的反应与亲代细胞系产生的数据相似(表1)。与亲代细胞系相比,EMT6-Luc对抗mPD-L1的反应似乎略有改善(表1),但增加反应荧光素酶标签对在测试条件下的抗肿瘤功效的总体影响似乎很小。
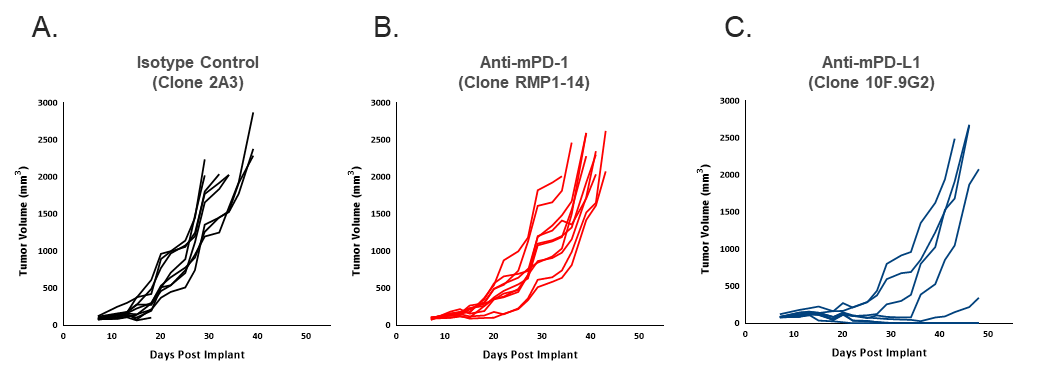
图2. 个别EMT6-Luc肿瘤体积测量显示抗mPD-1 (B)和抗mPD-L1 (C)与同种型对照(A)相比的抗肿瘤功效。每种抗体每周两次以10 mg/kg的剂量给药。
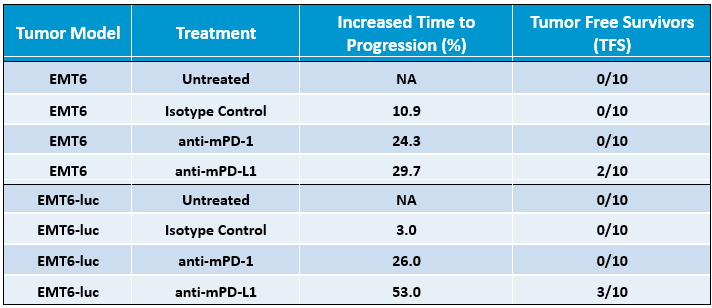
表1. EMT6和EMT6-Luc肿瘤模型对抗mPD-1和抗mPD-L1检查点抑制的差异化反应。进展时间增加终点基于从开始治疗到动物退出研究之间增加的天数(与未治疗的肿瘤相比)。
除了通过原发性MFP肿瘤测量评估对治疗的反应外,荧光素酶细胞系还可以通过评估体内BLI信号的部位来监测胸腔转移的发展。图3说明了胸腔信号的发展。不出所料,通过BLI进行监测可提供有关转移发生程度的更多详细信息,以及使用抗mPD-1或抗mPD-L1治疗转移的任何延迟。在研究过程中,所有对照动物的胸腔BLI信号均升高,但这些动物在肉眼尸检时均未出现转移性结节(数据未显示)。虽然必须进行病理学评估以确认胸腔信号增加的病因,但在未治疗的动物中,尸检后对肺结节的历史观察结果强烈表明,信号增加是由于转移引起的,突显了该终点的价值。以此假设为基础,可以得出结论,用抗mPD-L1进行治疗可导致转移的发生与原发肿瘤生长的延迟相一致。应当指出的是,该模型中的转移不会导致健康情况下降,因为小鼠在转移对健康产生影响之前退出了原发性肿瘤研究。
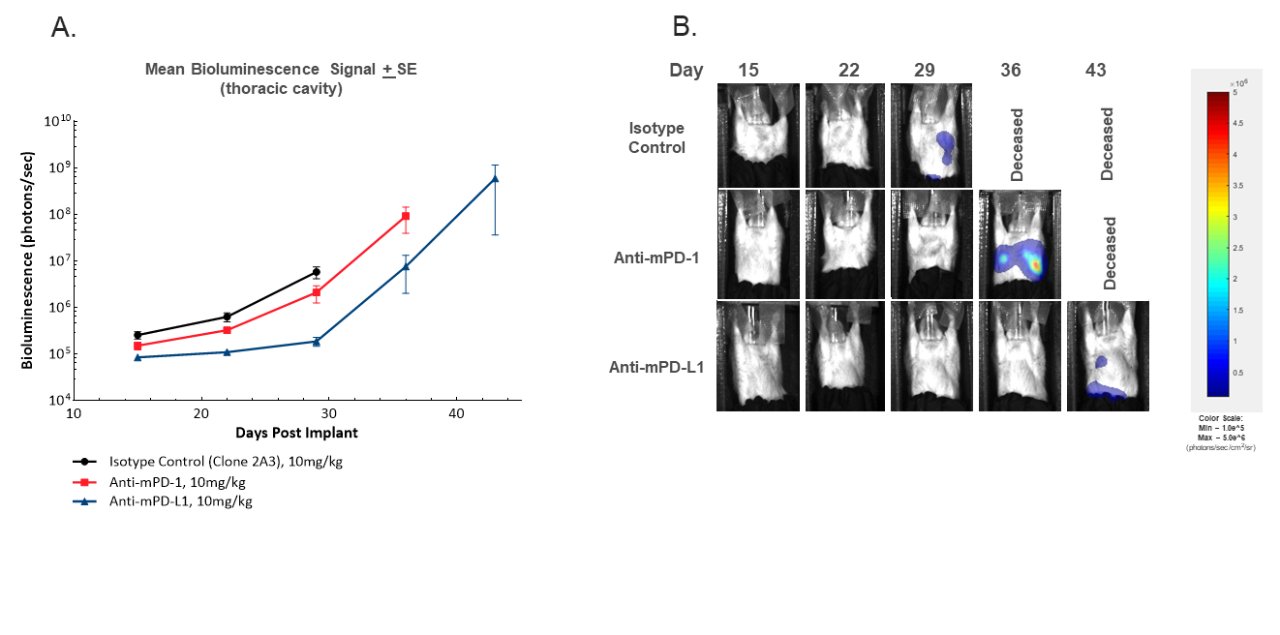
图3. 体内BLI成像可通过胸部区域(A)或代表性BLI图像(B)中的平均肿瘤负荷来监测胸部信号随时间推移的发展。
在研究免疫肿瘤学模型时,了解肿瘤中的浸润性免疫细胞的组成也很重要。为此,检查了150-550 mm3的原始态肿瘤的浸润性T细胞和以总CD45+细胞百分比表示的髓样细胞(图4)。所有肿瘤的骨髓区室均匀分布在M2巨噬细胞、单核MDSC和粒细胞MDSC中。M1巨噬细胞浸润相对低于其他髓样来源的细胞,而且与EMT6肿瘤相比,在EMT6-Luc肿瘤中略高。CD4+和CD8+ T细胞的浸润最小,但在EMT6和EMT6-Luc肿瘤中保持一致,NK细胞在EMT6-Luc肿瘤中略有升高。这种组成表明了免疫抑制性微环境,这有助于解释为什么接受测试的免疫疗法均仅出现有限反应。
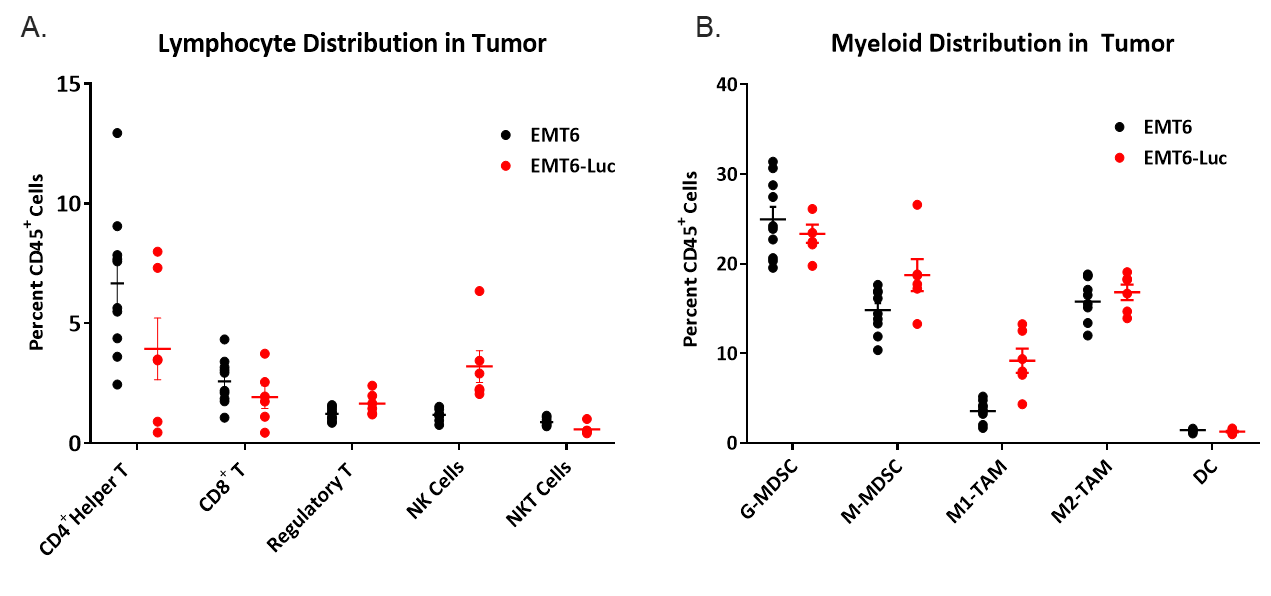
图4. 原始态EMT6和EMT6-Luc肿瘤中的淋巴(A)和骨髓(B)免疫细胞分布。
EMT6-Luc鼠类乳腺癌模型具有良好的免疫特性,可利用完整的小鼠免疫系统,并在免疫肿瘤学领域发挥强大的作用。这些数据支持使用MT6-Luc模型作为完善的临床前免疫肿瘤学模型,以评估原发性肿瘤的生长以及远处胸腔转移的形成。
Please contact us to speak with our scientists about how EMT6-Luc, or one of our other syngeneic models, can be used for your next immuno-oncology study.
参考资料
1“美国癌症协会:癌症事实与统计”。 美国癌症协会 | 癌症事实与统计,cancerstatisticscenter.cancer.org/?_ga=2.5394928.293340281.1606765768-996476487.1605734560。
2 Howlader N、Noone AM、Krapcho M、Miller D、Brest A、Yu M、Ruhl J、Tatalovich Z、Mariotto A、Lewis DR、Chen HS、Feuer EJ、Cronin KA(eds)。SEER Cancer Statistics Review,1975-2017,国家癌症研究所。Bethesda,医学博士,https://seer.cancer.gov/csr/1975_2017/,基于2019年11月提交的SEER数据,发布于SEER网站,2020年4月。
3Leal JHS and McArthur H. Breast cancer immunotherapy: From biology to current clinical applications. Eur. Med. J., 2020; 5(2): 113-124.
4Rockwell SC, Kallman, RF, Fajardo, LF。 连续移植小鼠乳腺肿瘤的特征及其组织培养适应性衍生物。 J. Natl. Can. Inst., 1972; 49(3): 735-749。
让我们开始对话
联系我们