作者:Maryland Franklin博士,科学研发副总裁
Date: October 2019
在美国,肺癌在男性和女性中都是第二大最常见的癌症,并且也是男性和女性癌症相关死亡的最常见原因。据美国癌症协会估计,到2019年将有228,150例肺癌新增病例(116,440例男性和111,710例女性)确诊,142,670例肺癌死亡病例(76,650例男性和66,020例女性)。
肺癌死亡人数在2005年达到159,292例的峰值,此后一直呈逐渐下降趋势。[1]但是,肺癌的五年存活率仅约为20%,远低于其他癌症。如果尽早发现肺癌,则五年生存率将攀升至约56%,但仅有约16%患者可在早期检测出肺癌。如果在晚期检测出癌症,五年存活率可能低至5%。
肺癌的治疗方法有很多,具体取决于确诊的肺癌类型和所处的疾病阶段。临床上使用了从外科手术、化疗、放疗、靶向疗法到免疫疗法的各种治疗方案。尽管取得了一些成功,特别是在某些基因突变的患者以及最近使用新型免疫疗法的患者中,但总体预后仍然很差。因此,需要不断研发新的肺癌治疗方法。
免疫疗法的出现需要同基因小鼠肿瘤模型进一步推动免疫肿瘤学治疗方法的发展。 其中一种模型是LL/2(Lewis Lung)肺癌模型,其特征已被徕博科表征为支持新型药物的研发。LL/2细胞系从Lewis肺癌模型的原发性肿瘤结节发展而来,该结节在C57BL小鼠中自发发展为肺表皮样癌。如下文所示,LL/2被归类为“冷性”肿瘤,具有较低的T细胞浸润性和较高的髓样抑制细胞浸润性。由于许多癌症患者对当前的免疫疗法无反应,因此了解“冷性”肿瘤模型是开发和利用同系小鼠模型以进行药物筛选和研发的要素。
LL/2肿瘤免疫特征
使用徕博科 CompLeukocyteTM工具包对6个未经治疗的肿瘤(约500mm3)进行分析后确定了LL/2肿瘤浸润的基线免疫特征。在浸润这些肿瘤的CD45+细胞中,M-MDSC所占比例最大(37%),其次是G-MDSC(22%)和M2 TAM(20%)。T细胞(CD8+和CD4+)以及M1 TAM、B细胞、NK、NKT和树突状细胞最少(图1)。总体特征显示此为非免疫原性模型。
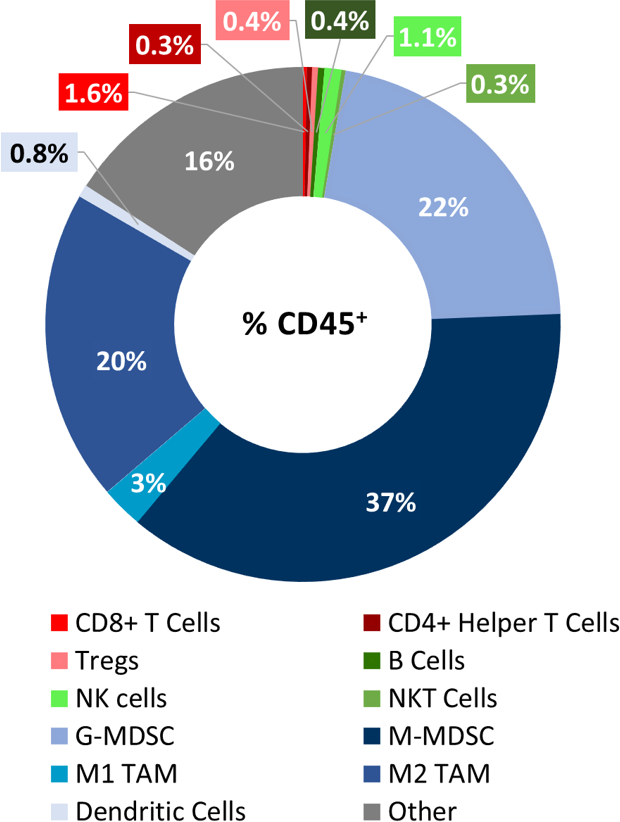
图1:浸润LL/2模型的肿瘤免疫细胞免疫表型。
LL/2生长和对治疗的反应
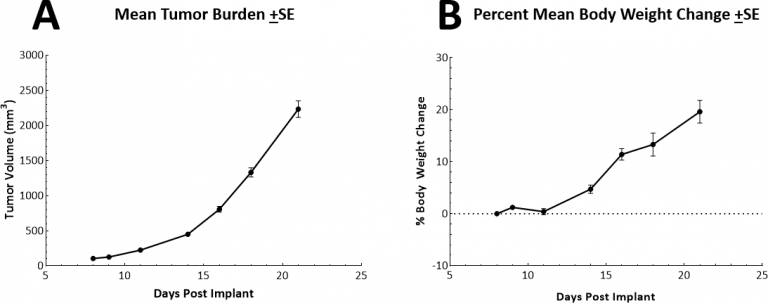
皮下LL/2肿瘤的体内倍增时间极短,约为2.5-3天。这就促成了一个模型,该模型可以促进长达两周的给药窗口,供受试药物激发其抗肿瘤活性。该模型本身不会导致体重减轻(图2A,2B)。
肺癌有多种化疗方法,为此,我们在LL/2模型中测试了阿霉素和紫杉醇作为单药疗法。阿霉素是一种具有广谱抗肿瘤活性的蒽环类药物,紫杉醇是一种微管蛋白结合剂,已广泛用于治疗非小细胞肺癌(NSCLC)。在LL/2模型中,两种测试药物均未在我们研究的剂量和方案中显示出有意义的抗肿瘤反应(图3A和B)。
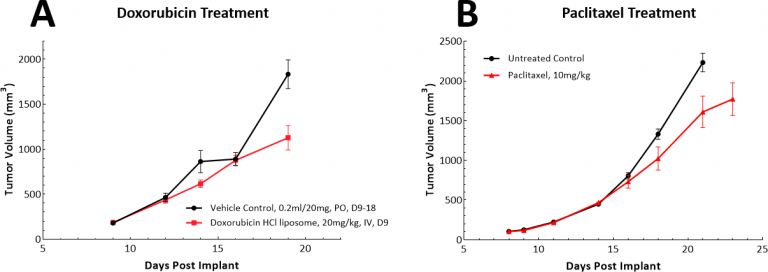
图3:LL/2皮下肿瘤对阿霉素或紫杉醇单药治疗的反应。
随着免疫疗法的出现,我们还研究了LL/2模型是否会对单药检查点抑制剂抗PD-1或抗PPD-L1产生反应(图4)。图4展示了同种型对照抗PD-1或抗PD-L1治疗后的平均肿瘤体积(图4A)和个体肿瘤体积(图4B、C和D)。一旦肿瘤形成(〜100mm3),便开始使用所有受试药物给药。不出所料,由于该模型中高度免疫抑制性的肿瘤微环境,两种测试剂均未显示出治疗效果。然后,我们继续推测紫杉醇与免疫检查点抑制剂的联合疗法是否会产生共同功效(图5A和B)。但是,对于充分巩固模型具有“冷性”表型部位的小鼠,这种方法并没有改善结果。三药联合疗法可能会在此模型中发挥功效,此模型适合寻求“冷性”肿瘤治疗方法的人。
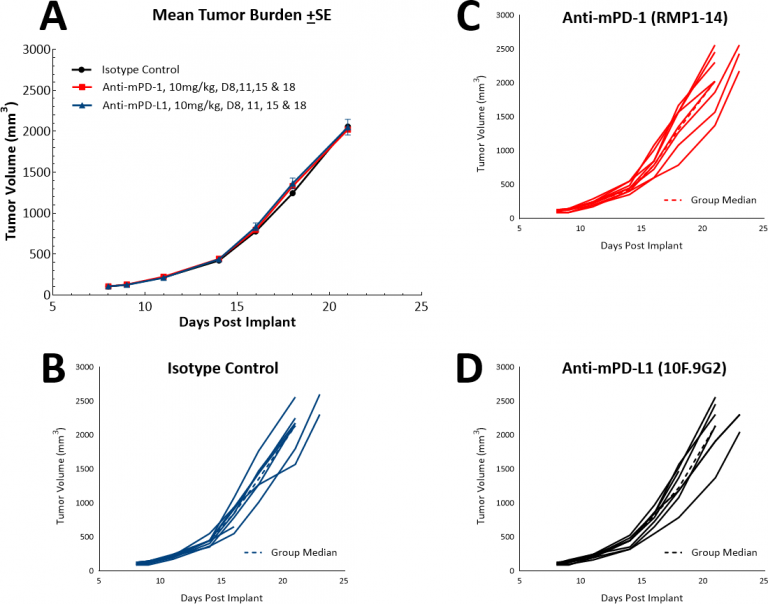
图4:LL/2皮下肿瘤对单药检查点抑制剂抗mPD-1和抗mPD-L1的反应。
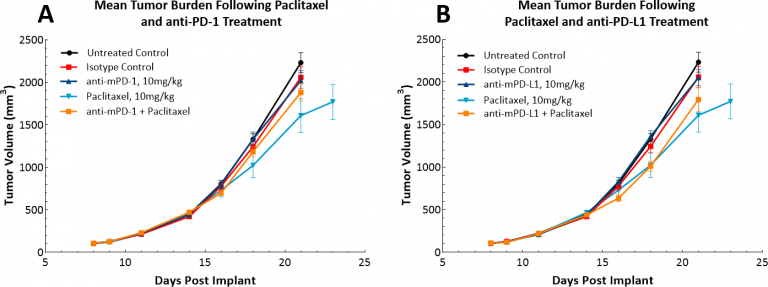
图5:LL/2皮下肿瘤对检查点抑制剂与紫杉醇联合疗法的反应。
单独进行局部放疗或与抗PD-1联合治疗后的LL/2肿瘤
在肺癌患者中,放疗通常作为姑息性单一疗法单独使用,也可以与化疗联合使用。 While focal radiation is highly recommended, we have utilized our RadSource RS-2000 to deliver localized radiation in a few models. 在皮下LL/2模型中,我们在骶骨部植入皮下肿瘤的小鼠中测试了单次高剂量(20Gy)局部放疗。我们发现,在对照组中,放疗将肿瘤生长到评估尺寸的时间从20天增加到36天。随着加入抗PD-1,评估时间略微增加至38.5天,这表明联合疗法无额外益处(图6)。但是,在此模型中可以进一步检测放疗、免疫检查点阻断和新型疗法的三重联合疗法。
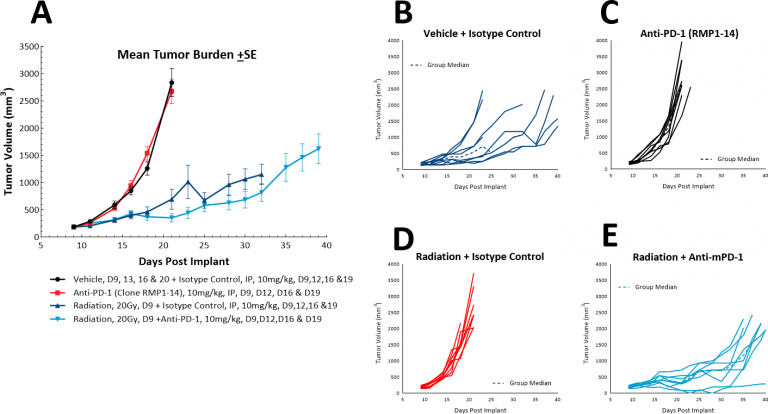
图6:LL/2皮下肿瘤对局部放疗与抗PD-1联合疗法的反应。
皮下肿瘤模型可用于快速且相对容易地评估抗肿瘤活性。然而,根据植入部位的性质,这些肿瘤可能无法复制所需的所有更密切代表患者疾病的生物学特征。为此,我们拥有LL/2、LL/2-Luc-M38的荧光素酶版本,用于在原位肺部环境中研发LL/2模型。
LL/2鼠肺癌模型可以用作临床前免疫肿瘤学模型。我们的数据支持使用该工具来研究与放疗或检查点抑制剂的新型联合疗法,或“冷性”非免疫原性肿瘤的其他新型治疗方法。
请 contact us to speak with our scientists about how LL/2 or one of our other syngeneic models can be used for your next immuno-oncology study.
参考资料
让我们开始对话
联系我们