作者:Sumithra Urs,博士 | 科研科学家
Date: June 2019
Pancreatic cancer is the ninth most commonly diagnosed cancer and ranks as one of the deadliest with the lowest 5-year survival rate of 5-8%.[1,2,3] This year alone, the American Cancer Society estimates that 56,770 people will be diagnosed with the disease of which more than 45,750 people may not survive. Pancreatic ductal adenocarcinoma (PDAC) being the most prevalent and aggressive form of exocrine pancreatic cancer accounts for ~90% of cases with mortality equaling incidence.[4,5]
确诊时,绝大多数PDAC患者患有局部晚期、不可切除或转移性疾病。疾病的无声蔓延以及仅在晚期才出现的疾病特异性症状使得早期疾病检测极具挑战性,并导致存活率较低。可切除患者的治疗方案包括手术后进行一线全身化疗(吉西他滨、FOLFIRINOX、紫杉醇)或联合放化疗。 For locally advanced, unresectable patients, the regimen includes multi-agent chemotherapy (5-FU, oxaliplatin, irinotecan) or chemoradiotherapy.[6] As these treatments have offered limited benefits to pancreatic cancer patients, newer options like immunotherapy drugs are now being tested in clinical trials.
PDAC的特征是存在纤维化基质、突变负担低、缺乏CD8+ T细胞浸润以及存在免疫抑制性髓样细胞群,所有这些均导致典型的非免疫原性肿瘤特征。[7]目前力求增强治疗反应的方案着重于使用放疗(RT)等药物增加T细胞向肿瘤的转运。在大多数实体瘤中,仅RT就有可能激活免疫系统,从而在细胞毒性死亡和释放免疫刺激信号后触发抗肿瘤免疫反应。但是,在PDAC患者中,单独使用大剂量放疗或与化疗药物联合治疗的结果通常仍不能令人满意[8],而且使用单药免疫治疗药物的临床试验表明反应较差,反应率低至1-2%。[9]目前至少有21项临床试验正在研究RT与其他免疫刺激剂的联合治疗,这可能是一种有希望的PDAC治疗途径,值得进一步研究。[10] 在同一临床试验平台上,我们正在使用Pan02鼠类PDAC模型评估单药和联合治疗。Pan02是一种成熟的II级腺癌模型,由在雄性C57BL/6小鼠中使用3-MCA(3-甲基胆固醇)化学诱导研发而成。[11] 在此模型中,我们展示了关于Pan02肿瘤模型生长动力学的体内数据、对免疫调节抗体的反应、局部放射以及在同系C57BL/6小鼠品系中测试的RT和免疫调节剂联合治疗。
Pan02生长参数
皮下植入Pan02可成功形成肿瘤,其倍增时间中位数为4-5天,小鼠在植入后约30天继续接收研究(图1)而未出现体重减轻(数据未显示)。根据生长动力学,可提供超过三周的治疗窗口以评估该模型中的抗肿瘤反应。

通过流式细胞术对Pan02肿瘤的免疫分型分析证实淋巴样细胞浸润性差(图2)。 While CD8+ and CD4+ helper T cells constituted only 1.6% and 1% of the CD45+ population, respectively, the immunosuppressive myeloid cell populations were present in abundance.M-MDSC以及M1和M2 TAM是主要的细胞亚群。该肿瘤的免疫特征是非免疫原性或“冷性”肿瘤模型的特征,类似于在PDAC患者中观察到的情况。

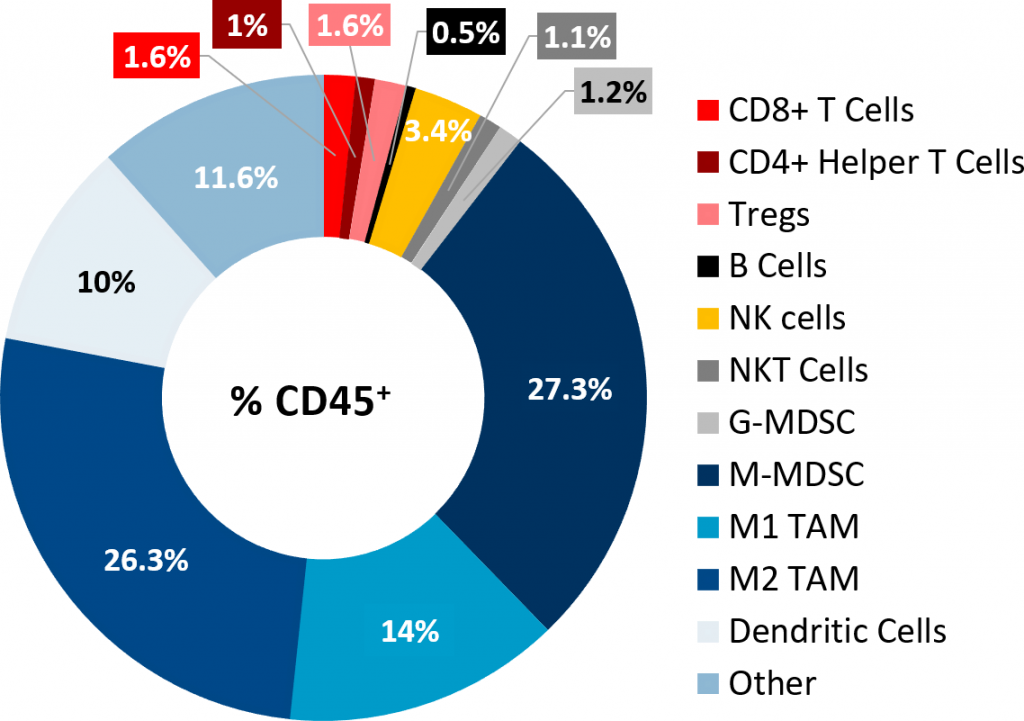
图2:皮下Pan02肿瘤的肿瘤免疫特征。
Pan02对单药治疗的反应
吉西他滨(100mg/kg,Q3Dx4(胰腺癌患者最常用的化疗防范之一)对Pan02荷瘤小鼠的单药治疗耐受性良好,并产生了具有统计显著性的肿瘤生长延迟(TGD)(图3)。

图3:Pan02对吉西他滨的反应。
根据临床上对PDAC免疫疗法的研究,我们着手评估Pan02模型对多种免疫调节抗体的反应性(图4)。然而,与Pan02肿瘤的免疫抑制特征一致,该模型不出意料地对检查点抑制剂抗mPD-1、抗mPD-L1和抗mCTLA-4以及共刺激抗体抗mCD137和抗mOX40的反应极小/无反应。所有抗体每周两次以10mg/kg的剂量给药,总计4次给药(图4)。

图4:Pan02对免疫调节抗体的反应。
Pan02对放射和联合治疗的反应
放疗通常用于治疗PDAC患者。我们在小鼠模型中采用小型动物放射研究平台(SARRP;Xstrahl)对肿瘤直接进行单剂量局部放射(5Gy或10Gy)治疗,并观察到,相比未接受治疗的对照组分别有9.5和22天的肿瘤依赖性生长延迟(图5)。
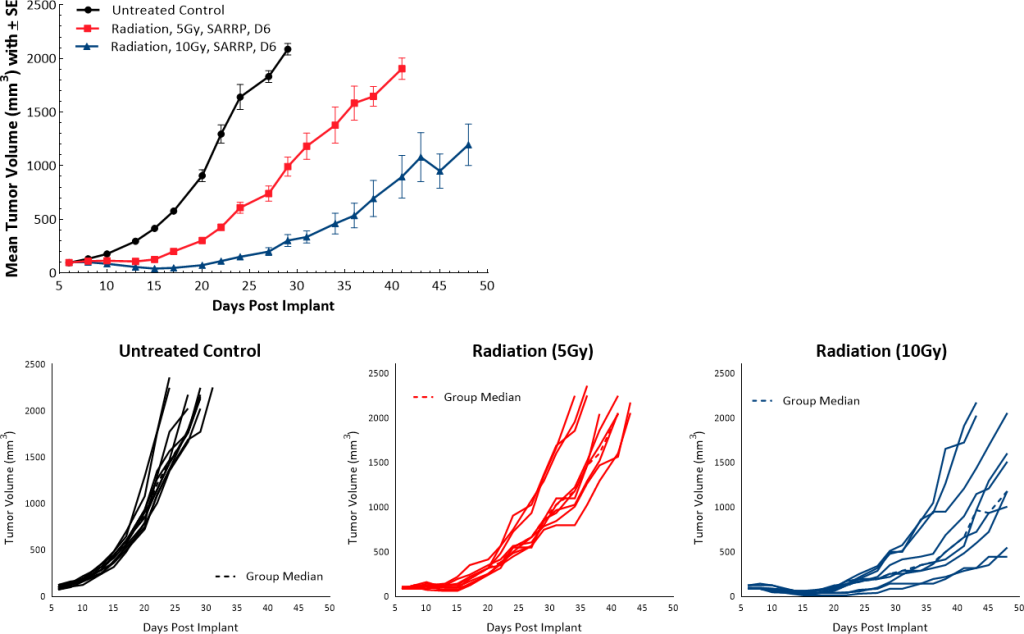
图5:Pan02对局部放射的反应。
为研究RT与检查点抑制剂联合治疗的抗肿瘤作用,使用单剂量5Gy和抗mPD-1或抗mPD-L1抗体进行联合治疗。未治疗和同种型对照组显示出重叠的生长速率,并且单药检查点抑制剂抗mPD-1和抗mPD-L1治疗未引起任何抗肿瘤反应。尽管单剂量5Gy RT产生了相比未治疗对照组9.5天的TGD,但与检查点抑制剂联合使用并不能显著改善抗肿瘤反应。RT联合抗mPD-1或抗PD-L1产生了分别13天和11.2天的TGD(图6)。
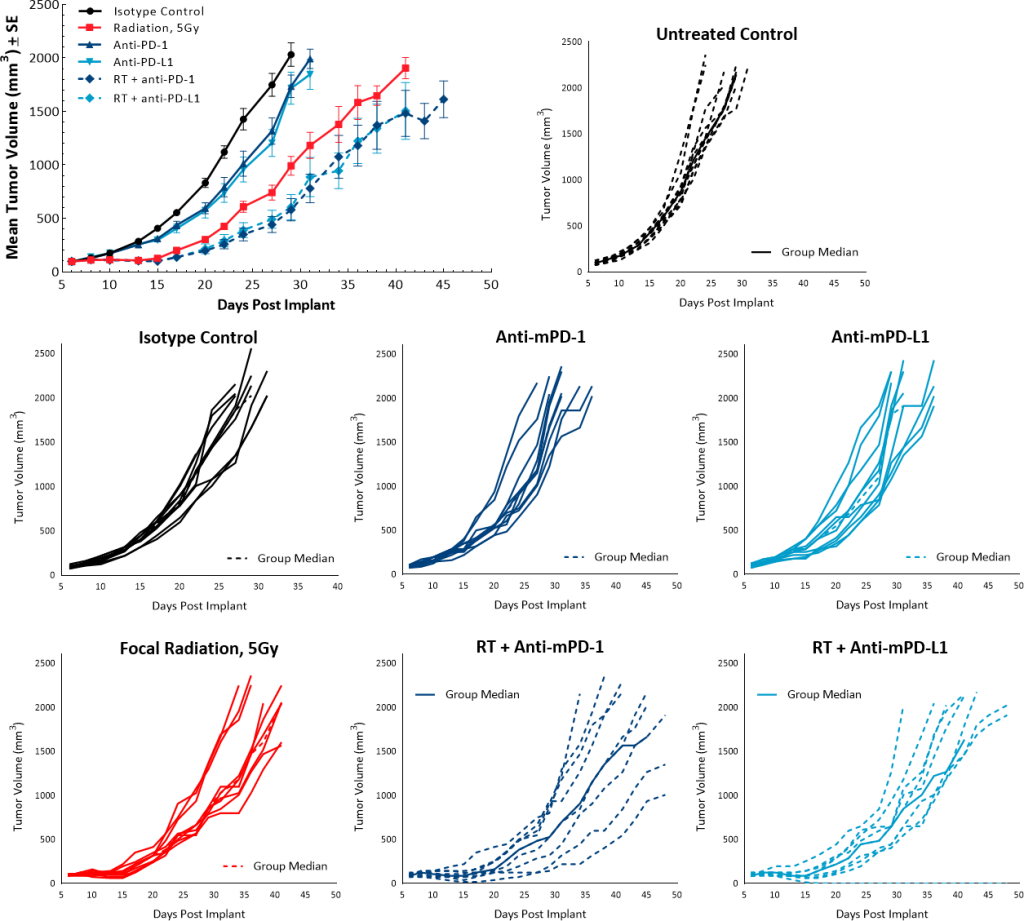
图6:Pan02对放射和检查点抑制剂联合治疗的反应。
Pan02模型的未来发展
目前正在开展研究以评估在皮下Pan02模型中使用多种联合治疗改善治疗反应的潜力。此外,我们最近已经生成了萤光素酶Pan02细胞系以支持原位研究。
参考资料
2SEER癌症统计资料。美国国家癌症研究所,NIH. (https://www.cancer.gov)。
3胰腺癌行动网络(https://www.pancan.org/)。
4Gunderson AJ、Yamazaki T、McCarty K等人。胰腺腺癌小鼠模型中成纤维细胞活化蛋白阻断联合放射治疗。《Plos One》 2019,14(2): e0211117。
5Kabacaoglu D、Ciecielski KJ、Ruess DA和Algul H. 胰管腺癌的免疫检查点抑制:当前的局限性和未来的选择。《Frontiers in Immunology》 2018,9:1876。
6Saung MT和Zheng L. 胰腺癌化疗的当前标准。《Clin. Ther.》 2017,39(11):2125-2134。
7Azad A、Lim SY、D'Costa Z等人。PD-L1阻断可增强胰腺导管腺癌对放射治疗的反应。EMBO,《Molecular Medicine》 2017, 9(2):167-180。
8Lauffer DC、Kuhn PA、Kueng M等人。胰腺癌:对于未切除和R1切除患者,放化疗联合高剂量放疗的可行性和结果。2018。《Cureus》 10(5): e2713。
9Javle M、Golan T和Maitra A。改变胰腺癌的病程 - 关注近期的转化进展。《Cancer Treatment Reviews》。2016;44:17-25。
10Gajiwala S、Torgeson A、Garrido-Laguna I、Kinsey C和Lloyd S。胰腺癌联合免疫治疗和放射治疗策略 - 针对癌症免疫周期的多个阶段。《J Gastro Oncol》,2018; 9(6):1014-1026。
让我们开始对话
联系我们