Date: October 2020
With the development of increasingly complex 免疫疗法, biotech/pharma companies are now looking for more relevant and accurate preclinical tumor models to predict precise drug responses.
临床前肿瘤学研究的目的是在动物环境中模拟人类疾病,而研究人员面临的最大挑战是结果的可转化性。理想的临床前肿瘤模型不仅将采用特定的癌症亚型,而且还将模拟肿瘤发生所需的复杂微环境。
最近的一些出版物表明,肿瘤植入部位会影响关键参数,例如肿瘤动力学、血管形成、结构、低氧环境以及对抗肿瘤治疗的敏感性1-4。
较常用的皮下(SC)模型具有通过卡尺监控肿瘤测量结果的优势。但是,它们在形态、血管密度、免疫细胞浸润和肿瘤微环境方面与内脏肿瘤不同。这正是原位(OT)肿瘤模型试图获得的数据,即将肿瘤细胞系或患者来源的异种移植物植入与组织类型相匹配的器官中。
在免疫疗法的特定背景下,已发表的数据表明,原位肿瘤模型具有较大的巨噬细胞免疫抑制作用,并且对某些类型的免疫疗法的敏感性低于皮下植入的相同模型2。
为了探索原位模型在相比皮下模型提供更相关的肿瘤微环境,同时充当肿瘤主要部位方面的潜力,我们已经为若干同系细胞系采用了萤光素酶,以促进对肿瘤进程和转移的无创监测。
在本模型聚焦中,我们介绍了小鼠胰腺癌细胞系Pan02-Luc的模型开发。注意:所有动物研究均已获得实验动物关怀与使用委员会的批准,并按照AAALAC认可的计划中的实验动物关怀与使用指南进行。人道安乐死标准是根据体重和确定的临床观察结果预先确定的。
Pan02-Luc的模型开发:小鼠胰腺腺癌细胞系
将Pan02-Luc细胞通过外科手术植入C57BL/6小鼠的胰头中,可产生约100%的肿瘤携带率且稳定的肿瘤生长,通过生物发光成像(BLI)确定的中位倍增时间约为6天。动物的中位生存期(发病率/死亡率)为58天,相对较长,这使得该模型可以进行5-6周的给药和疗效评估(图1)。肿瘤的植入和进展对体重没有任何不利影响,导致安乐死的最常见临床观察是腹胀(数据未显示)。
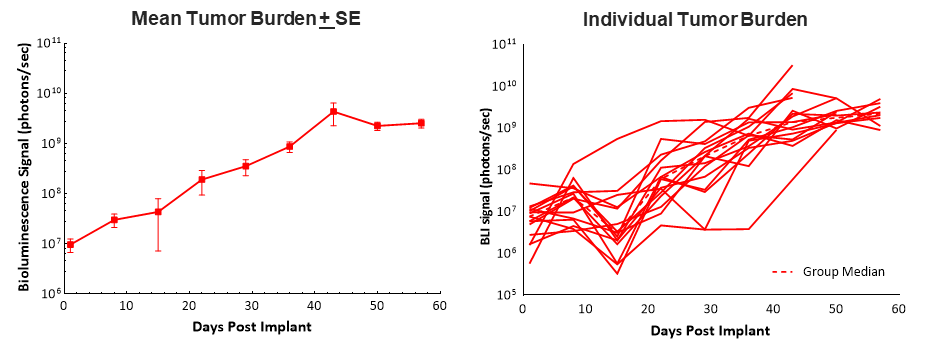
众所周知,胰腺癌被认为是“冷性”肿瘤,并且对免疫疗法反应不佳。因此,我们对检查点抑制剂抗mPD-1单药和与吉西他滨联合治疗进行了测试。
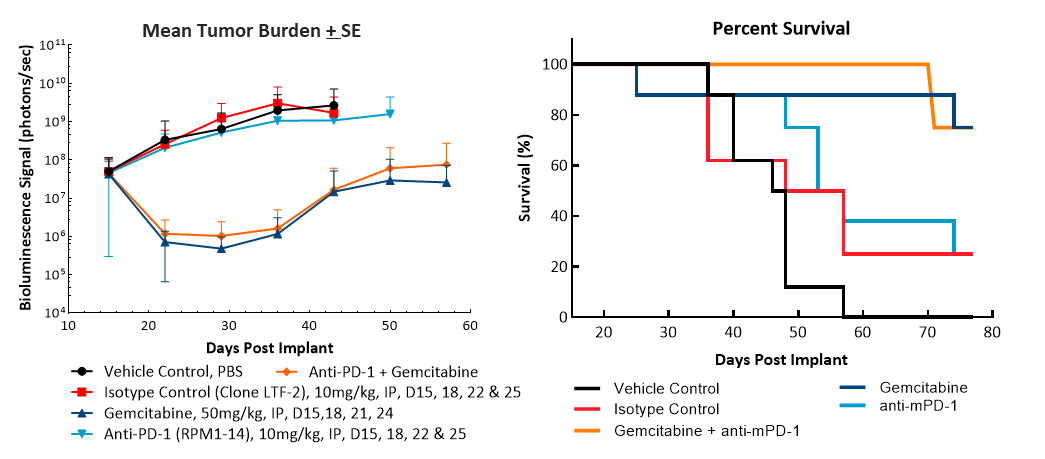
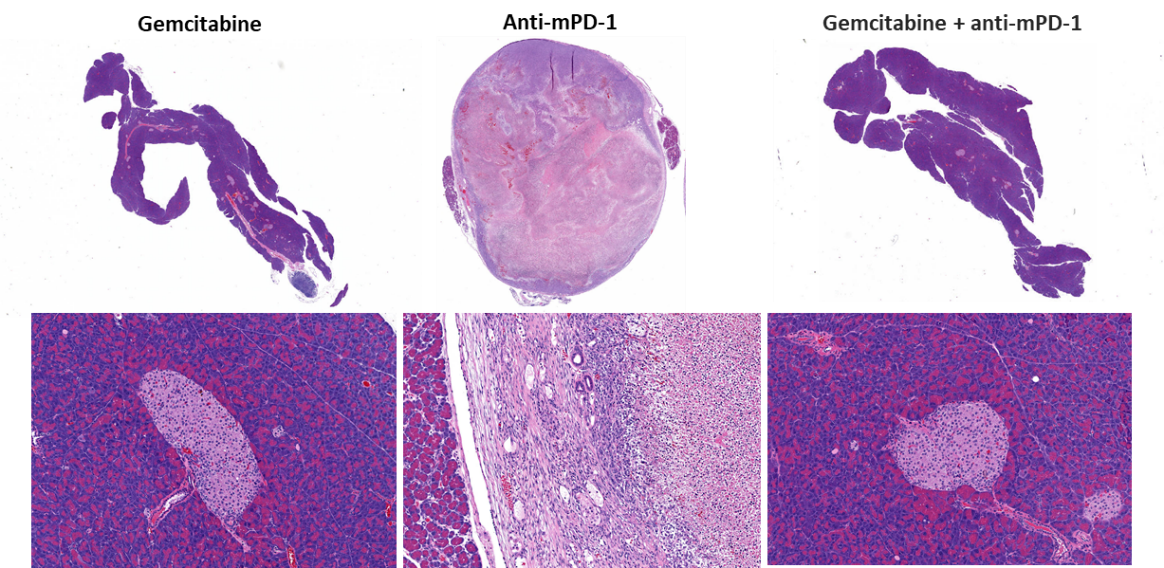
用抗mPD-1(10mg/kg)治疗后的疗效评估未显示任何有意义的反应(图2)。使用临床相关化疗制剂吉西他滨(50mg/kg)的标准治疗可以使87%(7/8)的动物肿瘤完全消退(CR),根据BLI测定,其中62%(5/8)的动物被视为无肿瘤幸存者(TFS)。治疗结束后在两只动物中观察到再生长。与吉西他滨单药相比,吉西他滨与抗mPD-1的联合用药未造成任何额外的TFS。研究结束时获得的肿瘤代表性生物发光图像(图2C)和组织学图像(图2D)证实了吉西他滨治疗组的肿瘤消退。
图2. Pan02-Luc对抗mPD-1和吉西他滨治疗的反应

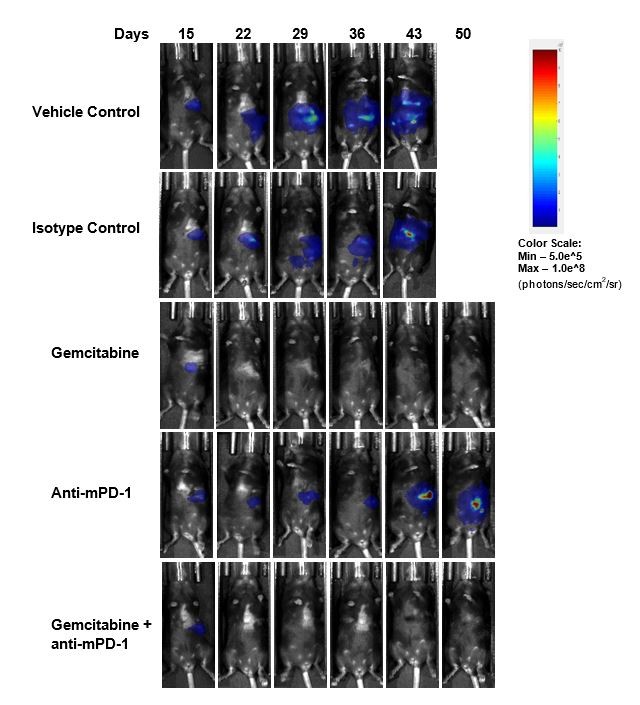
我们之前曾报告过皮下Pan02模型对免疫疗法的反应(请见往期模型聚焦)。因此,相比此处显示的采用Luc的Pan02细胞系的原位数据,我们发现原位模型中对抗mPD-1的反应类似于皮下亲代Pan02模型。相比皮下模型,在原位模型中给予相同剂量浓度的吉西他滨的反应明显更高,动物表现出肿瘤生长延迟和80% PR(部分消退)和20% CR,且无TFS(表1)。
表1. 皮下和原位Pan02肿瘤对吉西他滨治疗反应的比较
采用流式细胞术对免疫细胞原位肿瘤浸润的评估证实了非免疫原性或“冷性”肿瘤模型的不良淋巴样细胞浸润特征(图3A-B)。尽管CD8+和CD4+辅助T细胞仅占CD45+细胞群的1.6%和1%,免疫抑制性骨髓细胞群大量存在,单核细胞衍生的抑制细胞(M-MDSC)以及M1和M2肿瘤相关巨噬细胞(TAM)是主要的细胞亚群。原位和皮下模型的免疫特征比较表明,原位肿瘤中的调节性T细胞(Tregs)、自然杀伤细胞(NK)和自然杀伤性T细胞(NKT)明显减少。通常,在原位肿瘤中,髓样细胞群更为庞大,占CD45+细胞的82%,而在皮下模型中此比例为68%。原位肿瘤中的粒细胞-MDSC和M2-TAM显著较多,而树突状细胞则较少,表明更偏向抗炎性免疫抑制表型。
图3. 皮下和原位肿瘤的流式细胞仪分析
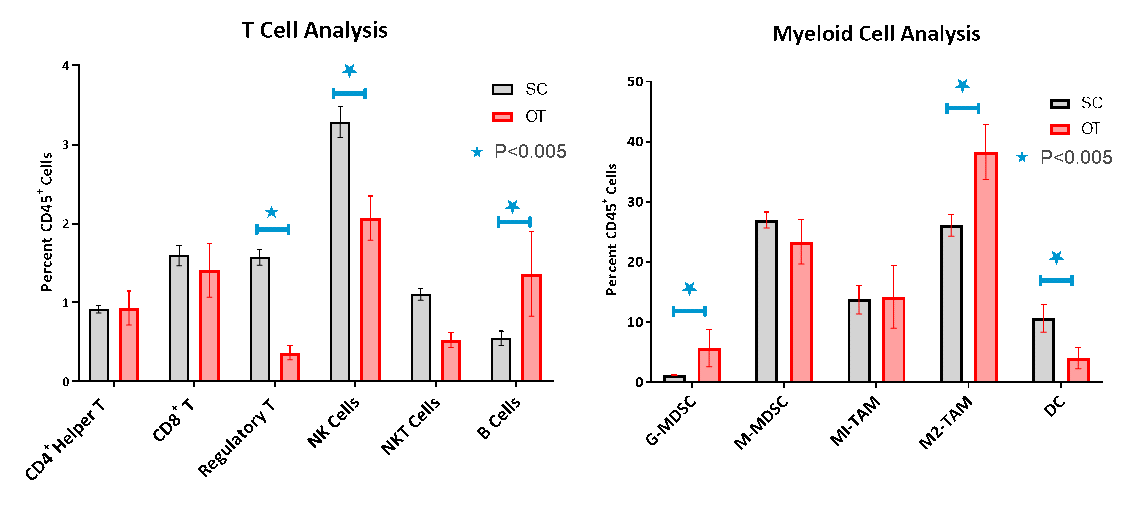
在我们看来,皮下和原位模型之间的这些细微差异可能会提供对我们研究的治疗反应强度的深度见解。据报告,这些差异在临床上至关重要,因为它们会影响胰腺癌患者反应和预后的可预测性5-7。
原位肿瘤植入可以更好地模拟临床情况,为癌症进展和药物反应进行建模。由于每个器官及其微环境都独一无二,并且无法通过皮下植入进行复制,因此,在可能的情况下使用原位模型非常重要。
At preclinical oncology, we offer several luciferase-enabled models for this purpose.
如果您有兴趣进一步讨论此模型,请联系我们。
参考资料
1. Erstad DJ, et al., 2018. 原位和异位鼠胰腺癌模型及其对FOLFIRINOX化疗的不同反应。Dis Model Mech.,7月1; 11(7): dmm034793
2. Devaud C, et al., 2014. 不同解剖部位的组织可以塑造和改变肿瘤的微环境,从而影响对治疗的反应。Mol Ther.,1月22(1):18-27
3. Guerin MV, Finisguerra V, Van den Eynde BJ, Bercovici N and Trautmann A, 2020. 临床前鼠肿瘤模型:结构化和功能性观点。eLife.,2020;9:e50740
4. Qui W and Su GH. 2013. 原位胰腺肿瘤小鼠模型的发展。Methods Mol Biol.,980:215-223
5. Kurahara H, et al., 2011. M2极化的肿瘤相关巨噬细胞在胰腺癌中的意义。J Surg Res.,5月15; 167(2):e211-e219
6. Parente P, et al., 2018. 胰腺导管腺癌的肿瘤微环境与免疫系统之间的交互:新治疗方法的潜在目标。 Gastroenterology Res and Practice. 2018:7530619
7. Lankadasari M, et al., 2019. 应对胰腺癌:用双刃剑作战。 Mol Cancer 18:48
让我们开始对话
联系我们