作者:Maryland Franklin博士,科学研发副总裁
Date: September 2018
卵巢癌被认为是一种相对罕见的妇科恶性肿瘤,但由于其在早期出现的症状具有非特异性,因此卵巢癌是死亡率最高的妇科肿瘤之一。这导致大多数女性在确诊时已是晚期。在美国,卵巢癌的发病率约为每年22,000例,每年导致约14,000例死亡。
即使在癌症治疗和手术方法方面取得了许多进展,但卵巢癌治疗领域对患者群体产生重要影响的进展却少之又少。尽管初始反应率可能很高,但一线治疗后超过80%的患者会复发,并且这些女性中超过50%的患者会在诊断后5年内死亡。
1线难治性患者有限的二线治疗方案选择以及晚期确诊导致了整体生存率低下,这使得卵巢癌成为一个肿瘤药物筛选的活跃领域,也是一个未攻克的重大医学难题。最近,免疫疗法在其他癌症中取得的成功为卵巢癌患者带来了一些希望。有数据报告称,肿瘤浸润淋巴细胞的存在与卵巢癌患者整体生存率的改善呈正相关,这是该领域最令人充满希望的数据之一。[1]
用作临床前同源模型的ID8鼠卵巢癌模型
At Labcorp we have established the ID8 murine ovarian carcinoma model as a preclinical syngeneic model that can be used to track and monitor disease progression and therapeutic outcomes. 我们的模型依赖于表达荧光素酶的ID8细胞的腹膜内递送来模拟人类疾病的各个方面。植入体内后,ID8-luc细胞表现出7-8天的肿瘤倍增时间,中位总生存期约为40-50天。在该模型中未观察到随时间推移的体重减轻。然而,由于和晚期疾病有关的腹水积聚,体重增加十分常见(图1A、B、C)。
图1:随时间推移对C67BL/6小鼠的ID8-luc模型进行体内评估
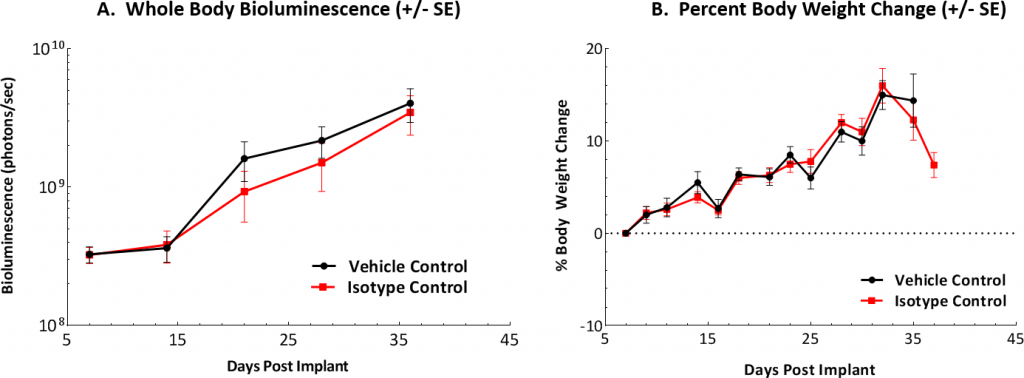
图1A:IP植入后在对照小鼠中发现的肿瘤负荷的图形表示。
图1B:每周测量三次体重,并显示从植入当天(第0天)开始的变化百分比。
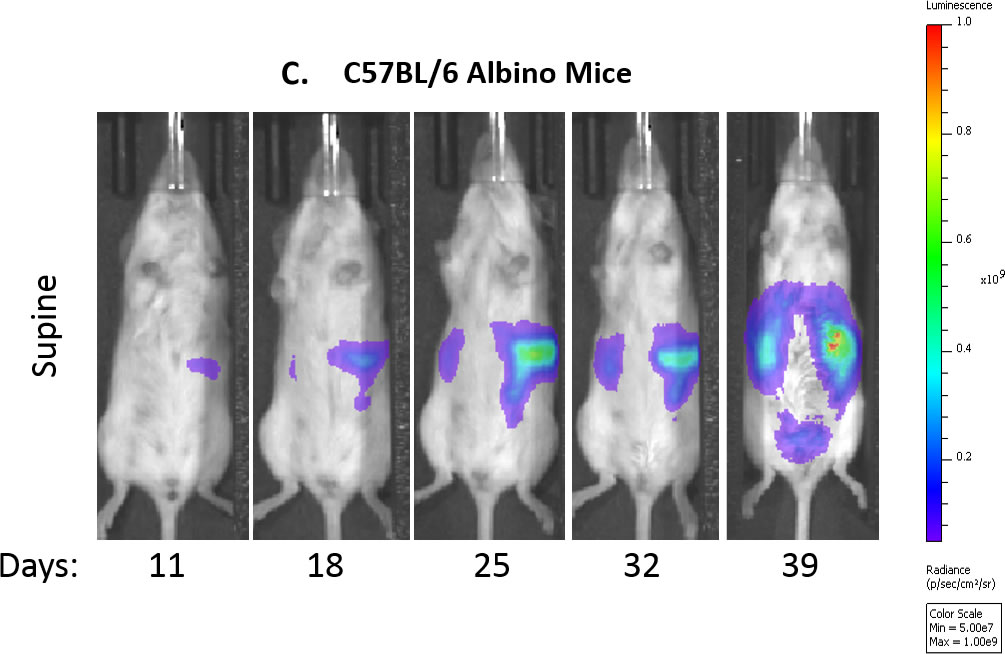
图1C:对照小鼠随时间变化的代表性生物发光图像。
腹水的免疫表型评估
临床观察包括晚期疾病状态下由于腹水积聚而导致的腹部膨胀。尸检时,观察到腹膜腔内的实体瘤结节,包括胰腺、肝脏、脾脏和腹壁。
了解同基因模型的免疫细胞谱是选择模型时要考虑的重要方面。因此,我们评估了腹水的免疫表型(图2A、B、C),并发现大量的B细胞、粒细胞髓样来源的抑制细胞(G-MDSC)以及M1和M2肿瘤相关的巨噬细胞(TAM)。 目前正在对观察到的实体瘤结节进行进一步评估。
图2:来自植入ID8-luc的小鼠的腹水免疫表型
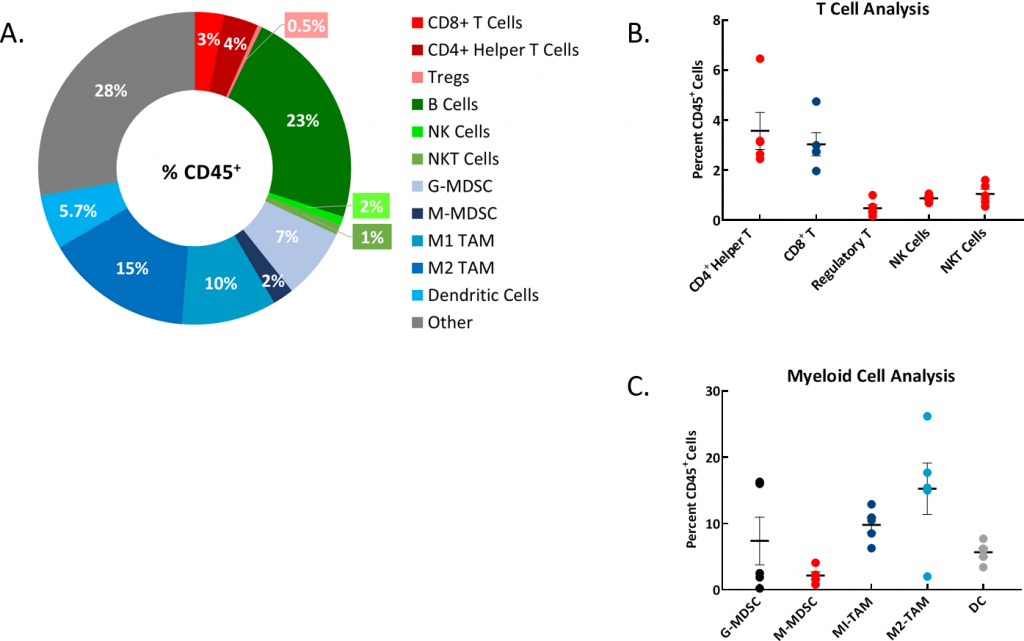
图2A:代表性环状饼图显示了免疫细胞群的分布占整个CD45+细胞群的百分比。
图2B:T细胞群分析。
图2C:对骨髓细胞群的分析。使用n=5个个体小鼠的腹水样本进行研究。
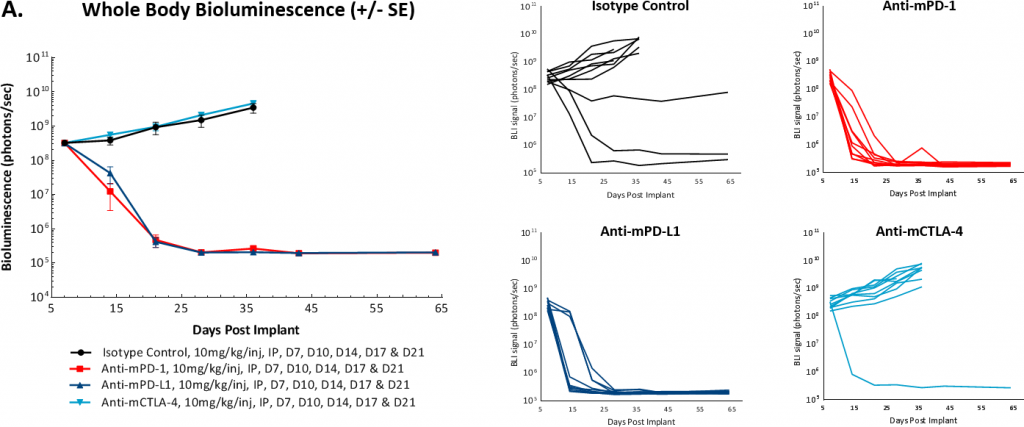
为了确定模型是否对免疫检查点抑制有反应,我们在肿瘤细胞植入后7或14天开始测试抗mPD-1、抗mPD-L1和抗mCTLA-4抗体。与许多实体同源肿瘤模型一样,我们发现对这些疗法的反应取决于治疗开始的时间。在图3A和3B中,我们展示了在肿瘤细胞植入7天后开始用抗mPD-1或抗mPD-L1抗体治疗导致肿瘤完全消退,因此该分期不适合进行药物联合治疗。相比之下,该模型对抗mCTLA-4治疗无效。此外,我们观察到,在第7天研究开始时,一小部分对照肿瘤会自发消退。
图3:腹膜内ID8-luc:随时间推移的平均和个体全身BLI信号
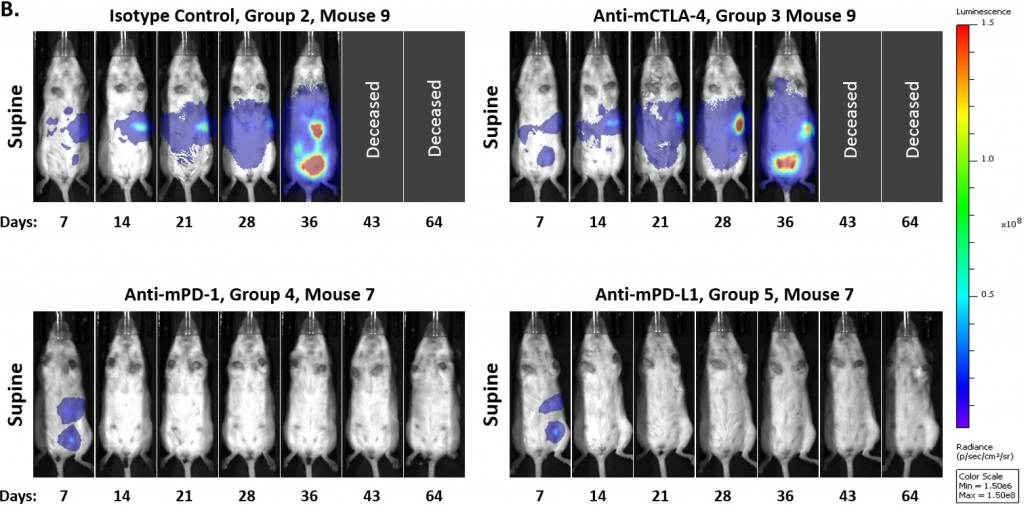
在一项后续研究中,我们将治疗开始时间推迟到肿瘤细胞植入14天后,并且没有看到对照肿瘤的自发消退。我们还看到了抗mPD-1或抗mPD-L1治疗的总体反应率的调节。但是,这些抗体似乎仍然产生了“全或无”的治疗反应。此外,将抗体剂量从10mg/kg降至5mg/kg不会对这些药物的抗肿瘤活性产生实质性影响(图4)。未来研究将评估抗体给药的进一步延迟,以确定我们是否可以继续降低这些检查点抑制剂的单药活性。
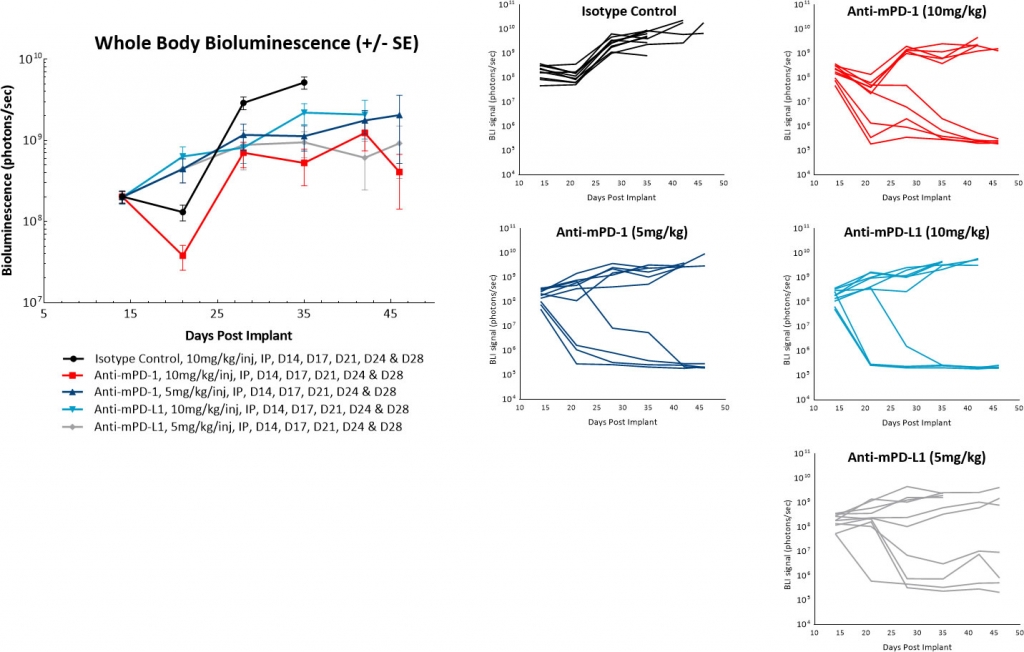
表1:肺癌细胞系
请参阅我们的A549生长曲线:
徕博科有多个肺癌细胞系(表1)可供使用。 Please contact us to run your next lung cancer study.
图4:腹膜内ID8-luc:用检查点抑制剂抗体治疗后的平均和个体全身BLI信号
参考资料
让我们开始对话
联系我们