Date: July 2020
联系临床前肿瘤科学团队以了解更多信息。
In February, we presented initial data of Labcorp's emerging humanized mouse platform utilizing human peripheral blood mononuclear cell (hPBMC) engraftment.
Our data using the NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ (NSG) mouse resulted in identification of four hPBMC donors that exhibited a treatment window of at least 30 days post hPBMC injection, consistent T cell engraftment, and growth of two human xenograft models, MiaPaCa-2 (pancreatic) and A549 (NSCLC), that was robust in hPBMC-engrafted NSG mice.
现在,我们展示了具有MiaPaCa-2或A549人类异种移植物的hPBMC植入NSG小鼠在接受pembrolizumab(Keytruda®,一种抗hPD-1)治疗后的初步功效数据。
实验设计
这些研究的目的是评估在NSG小鼠中植入hPBMC后,pembrolizumab对MiaPaCa-2或A549人类肿瘤模型的抗肿瘤反应。在AAALAC认可的研究中心,按照《实验动物饲养管理和使用指南》进行动物饲养管理和使用。
肿瘤一旦形成(~105-118mm3),则从三个不同的正常健康供体(Hemacare,美国加利福尼亚州洛杉矶)对NSG小鼠(Jackson Laboratories,美国缅因州巴港,品系#0005557)进行静脉注射hPBMC。hPBMC注射后第二天开始用pembrolizumab治疗。 Response to pembrolizumab, evaluation of onset of Graft vs. Host Disease (GvHD)-like characteristics were determined, and whole blood was collected at two timepoints for flow cytometry analysis of human lymphocyte markers to confirm donor engraftment of CD45+ cells, including CD4+ and CD8+ T cells.
MiaPaCa-2和A549控制hPBMC植入小鼠的肿瘤生长
未经治疗的对照动物的MiaPaCa-2肿瘤倍增时间(Td)为约7天,每个供体组中,给予hPBMC的动物的肿瘤倍增时间为约5至7天。
到第36天,所有三个供体的肿瘤均生长到1000-1200mm3的平均肿瘤体积,但是,在36天之后观察到组内和组间的某些差异。1000mm3之前的肿瘤生长似乎不受hPBMC植入的影响(图1)。
这些结果表明,利用这三个供体中的任何一个都适合MiaPaCa-2功效研究,生长到评估大小的时间(TES)为1000mm3。
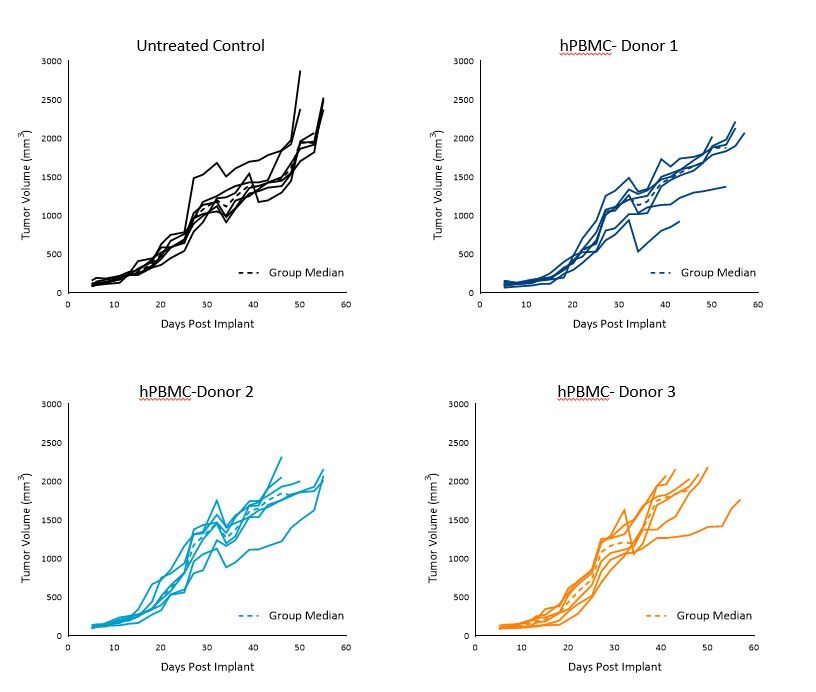
图1. hPBMC给药后,对照组MiaPaCa-2皮下肿瘤的生长
A549 未经治疗的对照组动物的肿瘤倍增时间为约11天,在每个供体组中,给予hPBMC的动物的肿瘤倍增时间为9至12天。
到第40天,来自供体1和3的hPBMC肿瘤平均生长至1000-1200mm3的平均肿瘤体积,并在第40天之后看到了一些生长变化。
组内变异在携带A549肿瘤和来自供体2的hPBMC的小鼠中最为明显(图2)。
These results suggest that donors 1 and 3 are most suitable for A549 efficacy studies with a TES of 1000mm3.
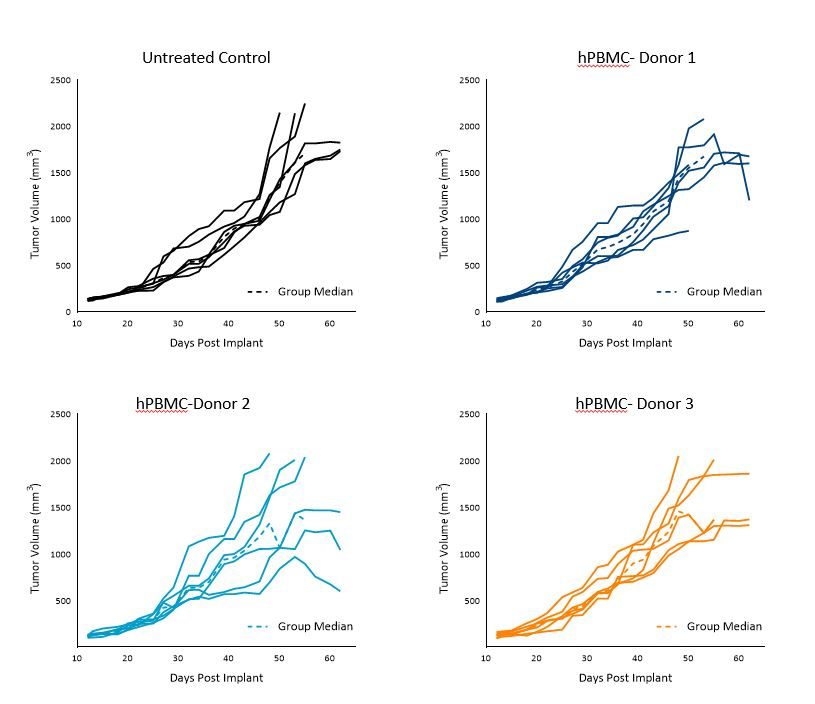
图2. hPBMC给药后对照组皮下A549肿瘤的生长
人淋巴细胞的植入和持久性
在hPBMC给药后第28天和第38天(MiaPaCa-2)或第42天(A549)通过免疫表型分析研究小鼠外周血中的人类免疫细胞标记物。
流式细胞仪标记物包括mCD45、hCD45、hCD3、hCD4和hCD8。 Human CD45+ cells, as a percentage of live cells from animals harboring either MiaPaCa-2 (Figure 3A) or A549 tumors (Figure 3B), are presented below and were used as an indicator of hPBMC engraftment.
We found that hCD45+ cells in whole blood were detected across all donors at both timepoints and were in line with published literature.1
虽然组内变异性很明显,但在第一时间点和第二时间点之间的平均植入程度保持一致或增加。在携带A549肿瘤的动物中,hPBMC的植入程度看起来确实高于携带MiaPaCa-2肿瘤的动物,这与我们最初的模型研发数据一致。
目前,尚不清楚这是研究之间的正常差异还是模型对移植的依赖性。
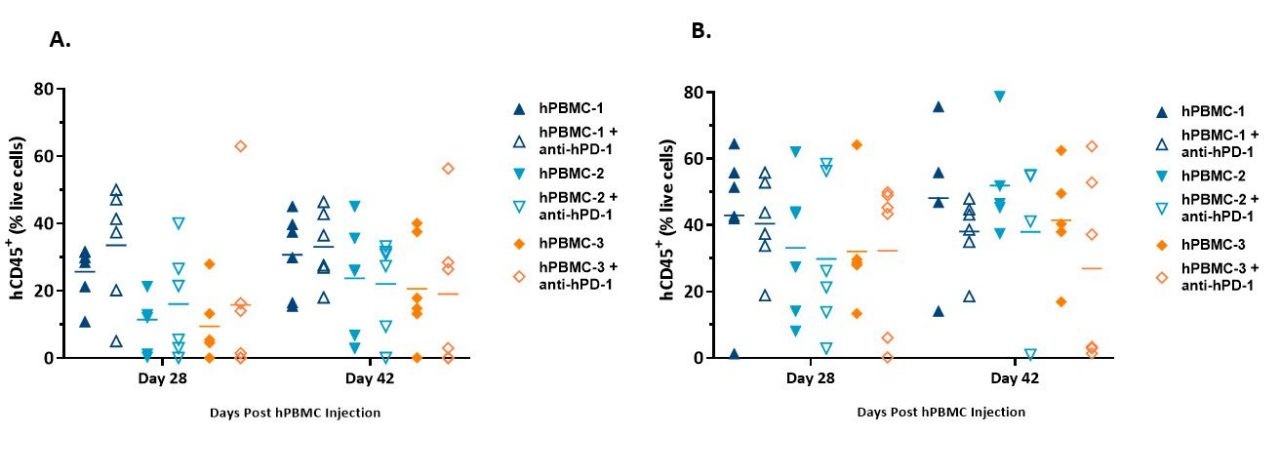
图3. 从给予hPBMC并携带MiaPaCa-2 (A)或A549 (B)异种移植物的NSG小鼠的全血中检测到的hCD45+细胞的植入。
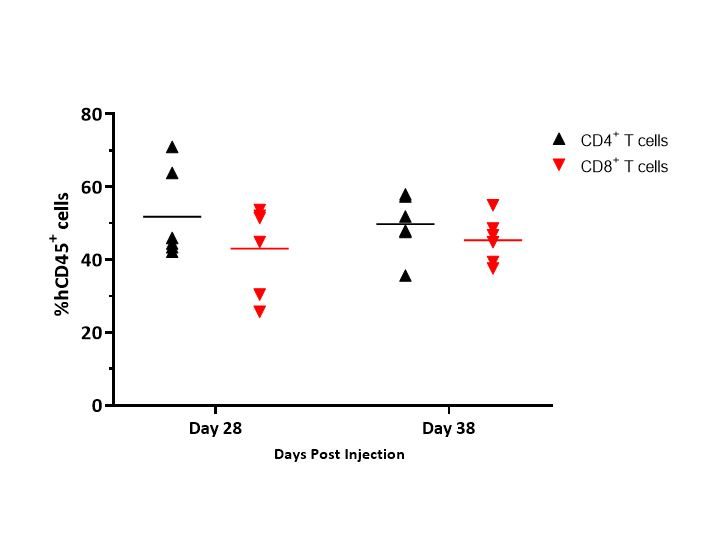
Figure 4 illustrates an example of distribution of CD4+ and CD8+ T cells in whole blood and illustrates that the distribution of T cells was consistent between timepoints.
尽管这些数据仅代表携带MiaPaCa-2肿瘤的小鼠中的供体1,但在所有供体和测试模型中报告了相似的数据。
Specifically, distribution of CD4+ and CD8+ T cells ranged from 42-65% and 32-46%, respectively, in MiaPaCa-2-bearing mice, and 51-67% and 22-44%, respectively, in A549-bearing mice (data not shown).
Onset of GvHD symptoms was monitored by body weight and clinical observations; though not confirmed pathologically in these studies, symptoms observed in these models are strongly correlated with the disease2 and with previous data (data not shown).
对Pembrolizumab的反应
有趣的是,在测试的条件下,pembrolizumab治疗在接受hPBMC移植的小鼠中未对任何供体的MiaPaCa-2或A549肿瘤的生长产生影响(图5和6)。
截至本文发布时,关于在携带MiaPaCa-2肿瘤、接受hPBMC移植的人源化小鼠中,对pembrolizumab的体内反应缺乏文献报道。
Notwithstanding, our data is reflective of a wide literature regarding the refractory nature of pancreatic tumors to immuno-oncology agents.3 Response of pembrolizumab against A549 appears moderate as reported previously, and that response seems to be donor dependent.4
尽管始终缺乏pembrolizumab对A549或MiaPaCa-2的反应,但这些模型对于将抗hPD-1作为合理联合用药方案的治疗方法仍有用处,因为对于不同供体之间的差异性反应具有很大的改进和评估空间。
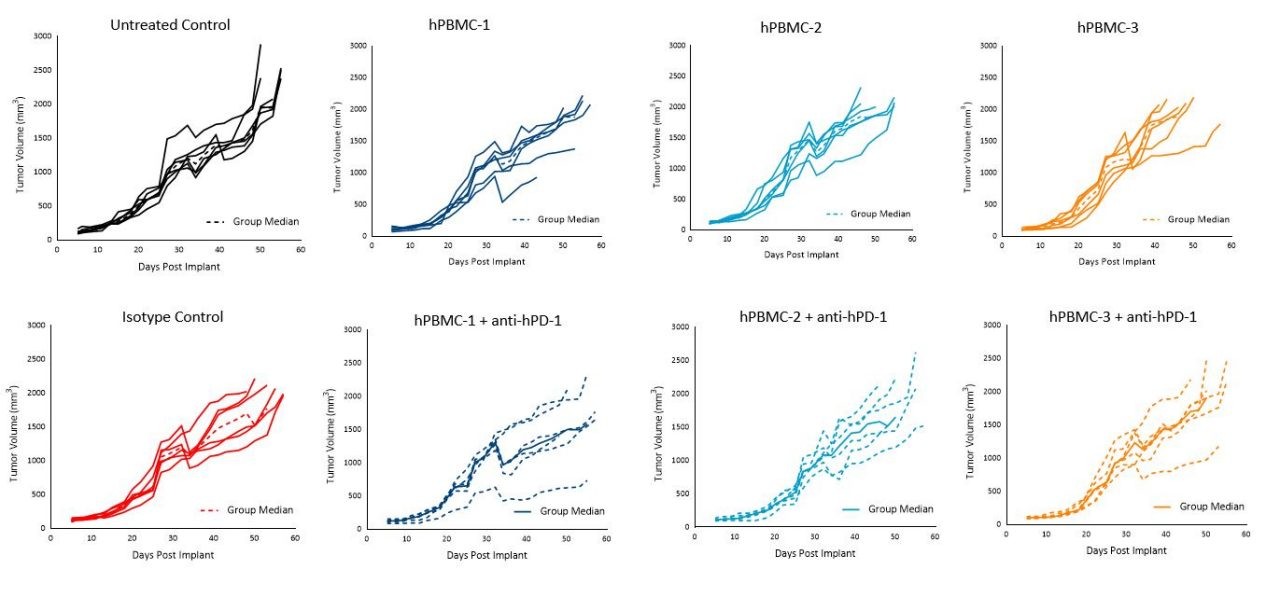
图5. 给予hPBMC和同种型对照或pembrolizumab(抗hPD-1)治疗后MiaPaCa-2皮下肿瘤的肿瘤生长
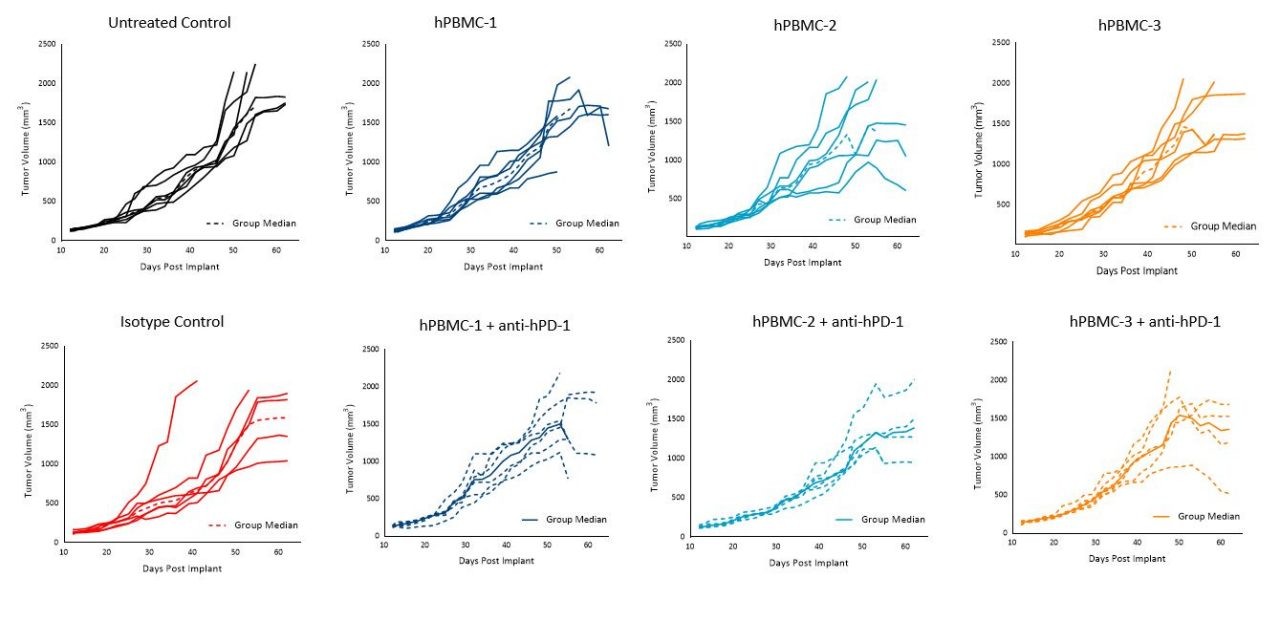
图6. 给予hPBMC和同种型对照或pembrolizumab(抗hPD-1)治疗后A549皮下肿瘤的肿瘤生长
向NSG小鼠给予hPBMC可导致人类T细胞在小鼠中持久存在,对MiaPaCa-2或A549肿瘤的生长影响最小。 该方法代表了一个强大的临床前平台,可用于研究利用人类T淋巴细胞指导直接抗肿瘤活性的新型人类药物的作用,并具有直接的临床意义。
未来研究将使用流式细胞术来分析针对hPBMC重构的NSG小鼠中人肿瘤异种移植物采用FDA批准的免疫疗法后,人类T细胞在肿瘤和周围组织中的浸润。
Labcorp has banked supplies of these human PBMC donors to be available for your research needs. Please contact our preclinical oncology scientists to see how hPBMC-engrafted NSG mice can be used for your next translational immuno-oncology study.
参考资料
1.Todd Pearson、Dale L. Greiner和Leonard D. Shultz。建立“人源化”小鼠以研究人类免疫力。2008. Curr Protoc Immunol 第15节:15.21单元
2.Sina Naserian、Mathieu Leclerc、Allan Thiolat、Caroline Pilon、Cindy Le Bret、Yazid Belkacemi、Sébastien Maury、Frédéric Charlotte和José L. Cohen. 简单、可重现和高效的急性移植物抗宿主病小鼠模型的临床评分系统。2018. Front. in Immun. (9): 10.
3.Robert J. Torphy、Yuwen Zhu和Richard D. Schulick。胰腺癌的免疫疗法:障碍和突破。2018。 Ann Gastroenterol Surg. 2(4): 274–281.
让我们开始对话
联系我们